题目内容
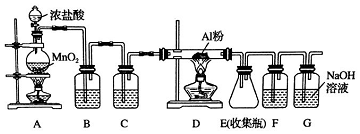
12.下列实验操作正确的是( )①用50mL量筒量取5.2mL稀硫酸;
②用分液漏斗分离苯和四氯化碳的混合物
③用托盘天平称量17.7g氯化钠晶体
④向小试管中加入100ml稀盐酸.
| A. | ①② | B. | ②③ | C. | ③ | D. | ②④ |
分析 ①液体的体积与量筒规格接近,减小误差;
②苯和四氯化碳的混合物互溶,不分层;
③托盘天平的感量为0.1g;
④小试管的体积一般不超过10mL.
解答 解:①液体的体积与量筒规格接近,减小误差,则用10mL量筒量取5.2mL稀硫酸,故错误;
②苯和四氯化碳的混合物互溶,不分层,不能选分液漏斗分离,应选蒸馏法,故错误;
③托盘天平的感量为0.1g,则用托盘天平称量17.7g氯化钠晶体,故正确;
④小试管的体积一般不超过10mL,则不能向小试管中加入100ml稀盐酸,故错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、混合物分离提纯为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
I2+SO2+2H2O═H2SO4+2HI
2FeCl2+Cl2═2FeCl3
2FeCl3+2HI═2FeCl2+2HCl+I2.
| A. | SO2>I->Fe2+ | B. | I->Fe2+>SO2 | C. | Fe2+>I->SO2 | D. | Fe2+>SO2>I- |
17.碳的两种同素异形体金刚石和石墨晶体结构如图(石墨晶体中是由一个个正六边形组成的片层结构,层与层之间靠微弱的范德华力结合)下列说法正确的是( )
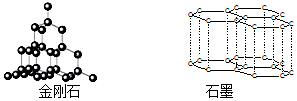
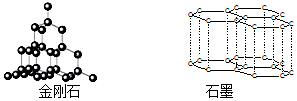
| A. | 根据:C(金刚石,s)+O2(g)═CO2(g)△H=-395.41 kJ•mol-1C(石墨,s)+O2(g)═CO2(g)△H=-393.5 kJ•mol-1说明金刚石比石墨稳定,石墨转变为金刚石为放热反应 | |
| B. | 相同质量的金刚石与石墨晶体中,所含共价键数相同 | |
| C. | 估计金刚石与石墨的熔沸点均较高,硬度均较大 | |
| D. | 现代科技已经实现了石墨制取金刚石,该过程属于化学变化 |
4.1mol SO2和1mol SO3具有相同的:①分子数 ②原子总数 ③硫原子数 ④氧原子数( )
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ①②③ |
1.下列化学反应中,离子方程式表示正确的是( )
| A. | 铜片插入硝酸银溶液中:Cu+Ag+=Cu2++Ag | |
| B. | 铁屑在稀H2SO4作用下产生H2Fe+2H+═Fe2++H2↑ | |
| C. | NaHCO3溶液与NaOH溶液反应H++OH-═H2O | |
| D. | H2SO4溶液与Ba(OH)2溶液混合产生沉淀 SO42-+Ba2+═BaSO4↓ |
15.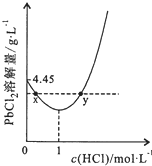 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
 20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )
20℃时,PbCl2(s)在不同浓度盐酸中的最大溶解量(单位:g•L-1)如图所示.下列叙述正确的是( )| A. | 盐酸浓度越大,Ksp(PbCl2)越大 | |
| B. | PbCl2能与一定浓度的盐酸反应 | |
| C. | x、y两点对应的溶液中c(Pb2+)相等 | |
| D. | 往含Pb2+的溶液中加入过量浓盐酸,可将Pb2+完全转化为PbCl2(s) |