题目内容
1.下列说法正确的是( )| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
分析 A、氢键是决定物质的物理性质;
B、过氧化钠与酸反应生成盐与水;
C、稀有气体单质分子中不存在任何化学键;
D、氯化铵是离子化合物.
解答 解:A、氢键是决定物质的物理性质,水分子的稳定性是化学性质,与氧的非金属性有关,故A错误;
B、过氧化钠与酸反应生成盐与水,是过氧化钠不是碱性氧化物,故B错误;
C、稀有气体单质分子中不存在任何化学键,故C错误;
D、氯化铵是离子化合物,所以由非金属元素组成的化合物不一定是共价化合物,故D正确;
故选D.
点评 本题考查物质结构与性质知识,难度不大,结合平时所学知识,举反例,即可解决问题.

练习册系列答案
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
11.有四组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如表所示:
下列各项判断正确的是( )
| 第一组 | A-268.8 | B-249.5 | C-185.8 | D-151.7 |
| 第二组 | F2-187.0 | Cl2-33.6 | Br2 58.7 | I2 184.0 |
| 第三组 | HF 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | H2Se 42.0 | H2Te-1.8 |
| A. | 第一组和第二组物质中一定含有共价键 | |
| B. | 第三组与第四组相比较,化合物的稳定顺序为:HBr>H2Se | |
| C. | 第三组物质溶于水后,溶液的酸性:HF>HCl>HBr>HI | |
| D. | 第四组物质中H2O的沸点最高,是因为H2O分子中化学键键能最强 |
12.下列每组物质发生变化所克服的粒子间的相互作用属于同种类型的是( )
| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
9.下列说法错误的是( )
| A. | ⅦA元素的氢化物中氟化氢的沸点最高 | |
| B. | 第三周期元素形成的简单离子的半径随原子序数的增大依次增大 | |
| C. | I2易溶于CCl4可以用相似相溶原理解释 | |
| D. | CH2=CH2分子中共有5个σ键和1个π键 |
6.下列物质的电子式正确的是( )
| A. |  | B. |  | C. |  | D. |  |
13.H2S是一种有臭鸡蛋气味的气体,其分子结构和H2O相似,但S-H键键能比O-H键键能低.下列判断错误的是( )
| A. | H2S分子呈V形 | |
| B. | H2S沸点低于H2O沸点,因为S-H键键能低 | |
| C. | H2S分子中只含σ键 | |
| D. | H2S分子稳定性低于H2O分子,因为O-H键键能高 |
10.通常把拆开1mol某化学键所吸收的能量看成该化学键的键能.已知部分化学键的键能如下:
(1)发射神舟飞船的长征火箭用了肼(N2H4,气态)为燃料,若它在氧气(气态)中燃烧,生成N2(气态)和H2O(液态).1mol肼完全燃烧时放出的热量为577kJ.
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
| 化学键 | N-H | N-N | O═O | N≡N | O-H |
| 键能 (kJ•mol-1) | 386 | 167 | 498 | 946 | 460 |
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH 溶液.肼-空气燃料电池放电时,正极的电极反应式是O2+2H2O+4e-=4OH-.
(3)已知N60分子中每个N原子均以氮氮键结合三个氮原子,且N60分子结构中每个氮原子均形成8个电子的稳定结构.试推测1个N60的结构含有90个N-N键.
11.能一次区分CH3COOH、CH3CH2OH、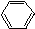 、
、 ,四种物质的是( )
,四种物质的是( )
 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |