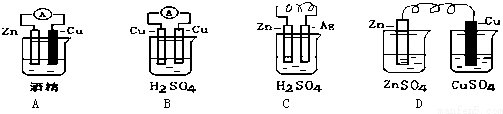
题目内容
12.下列每组物质发生变化所克服的粒子间的相互作用属于同种类型的是( )| A. | 碘和干冰升华 | B. | 氯化钠和冰的熔化 | ||
| C. | 二氧化硅和氧化钠熔化 | D. | 食盐和蔗糖熔化 |
分析 根据晶体类型判断,相同类型的晶体,克服的相互作用力相同;离子晶体克服的是离子键,分子晶体的是分子间作用力,原子晶体克服的是共价键,金属晶体克服的是金属键.
解答 解:A.碘、干冰都是分子晶体,升华均克服分子间作用力,故A正确;
B.氯化钠为离子晶体,熔化克服离子键,冰为分子晶体,熔化克服分子间作用力,故B错误;
C.二氧化硅为原子晶体,氧化钠为离子晶体,熔化所克服的粒子间的相互作用分别为共价键、离子键,故C错误;
D.食盐是离子晶体,蔗糖是分子晶体,克服作用力分别为离子键、分子间作用力,故D错误.
故选A.
点评 本题考查晶体类型与化学键,注意此类题的解题方法是:先判断晶体类型,再判断微粒间的作用力,题目难度不大.

练习册系列答案
相关题目
2.下列关于化学键的叙述,正确的一项是( )
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 含有极性键的分子一定是极性分子 | |
| D. | 含有共价键的化合物一定是共价化合物 |
20.某烃的结构简式为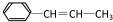 ,它可能具有的性质是( )
,它可能具有的性质是( )
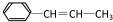 ,它可能具有的性质是( )
,它可能具有的性质是( )| A. | 可以发生加成、取代、氧化反应 | |
| B. | 能使溴水褪色,但不能使酸性高锰酸钾褪色 | |
| C. | 能发生加聚反应,其生成物可用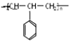 来表示 来表示 | |
| D. | 易溶于水,也易溶于有机溶剂 |
7.“水”电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 每生成2mol Na2Mn5O10转移4mol电子 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
4.下到化学用语表示正确的是( )
| A. | H2O2的电子式: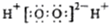 | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | C2H4与C3H6一定互为同系物 |
1.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
2.下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |