题目内容
13.H2S是一种有臭鸡蛋气味的气体,其分子结构和H2O相似,但S-H键键能比O-H键键能低.下列判断错误的是( )| A. | H2S分子呈V形 | |
| B. | H2S沸点低于H2O沸点,因为S-H键键能低 | |
| C. | H2S分子中只含σ键 | |
| D. | H2S分子稳定性低于H2O分子,因为O-H键键能高 |
分析 A、硫化氢中的硫是sp3杂化,中心原子周围有两孤对电子对;
B、水分子间存在氢键;
C、硫化氢分子中只存单键;
D、氧的非金属性强于硫;
解答 解:A、硫化氢中的硫是sp3杂化,中心原子周围有两孤对电子对,所以H2S分子呈V形,故A正确;
B、水分子间存在氢键,与化学键的键能无关,故B错误;
C、硫化氢分子中只存单键,所以H2S分子中只含σ键,故B正确;
D、氧的非金属性强于硫,所以H2S分子稳定性低于H2O分子,故D正确;
故选B.
点评 本题考查了化学基本概念和理论,涉及分子结构、共价键的类型、分子的稳定性,题目难度中等,结合所学知识是解题关键,注意氢键对水的沸点的影响.

练习册系列答案
相关题目
4.下到化学用语表示正确的是( )
| A. | H2O2的电子式: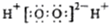 | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | C2H4与C3H6一定互为同系物 |
1.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
8.下列说法不正确的是( )
| A. | 电解质在融化状态下一定导电 | |
| B. | 常温下反应NH3(g)+HCl(g)=NH4Cl(s)能进行,则△H<0 | |
| C. | 常温下等pH的强酸HA和弱酸HB的两种溶液中,是的电离同等程度被抑制 | |
| D. | 恒温密闭容器中充入一定量的A进行反应:3A(g)?B(g)+2C(g),达到平衡后,在其它条件不变情况下,再充入一定量的A气体,A的转化率将不变 |
18.下列化学用语的表达正确的是( )
| A. | 原子核内有 10 个中子的氧原子:${\;}_{8}^{16}$O | |
| B. | 氢氧根离子的电子式: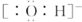 | |
| C. | 基态 Cr 的价电子排布式为:3d44s2 | |
| D. | 某元素原子的电子排布图: |
5.下列有关化学用语正确的是( )
| A. | NaOH的电子式: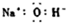 | B. | I4O9(碘酸碘)中碘的化合价为+3,+5 | ||
| C. | NH5的结构式为: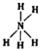 | D. | CO2的比例模型: |
2.下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
5.某实验探究小组用如图1装置来研究影响浓氨水与生石灰反应制氨气的反应速率(实验在通风柜中进行).
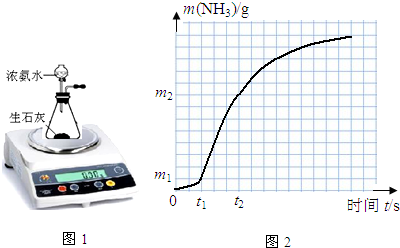
(1)有人认为:既然是以测定氨气的量来求反应速率,装置需再作改进,在上图中画出需改进的装置并注明所盛试剂的名称(不必考虑空气成分的作用).
根据改进后的装置进行实验,通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量可求反应速率v(NH3).为实现如表的实验目的,请完善以下实验方案(c(NH3•H2O)=15mol•L-1、CaO的质量相同、若溶液的体积相同实验过程中温度变化基本相同)和实验结论(填写待测物理量及用字母表示的数据)
(2)根据实验1的结果绘制出如图2反应速率曲线.则
①若忽略溶液体积的变化,以氨水浓度变化量表示t1~t2时间内的反应速率为v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s)(用代数式表示);
②若将30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率快(填“快”、“慢”、“相等”或“无法确定”),其原因是a.起始氨水浓度大;b.氨水的体积少,(CaO与H2O)反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.

(1)有人认为:既然是以测定氨气的量来求反应速率,装置需再作改进,在上图中画出需改进的装置并注明所盛试剂的名称(不必考虑空气成分的作用).
根据改进后的装置进行实验,通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量可求反应速率v(NH3).为实现如表的实验目的,请完善以下实验方案(c(NH3•H2O)=15mol•L-1、CaO的质量相同、若溶液的体积相同实验过程中温度变化基本相同)和实验结论(填写待测物理量及用字母表示的数据)
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
①若忽略溶液体积的变化,以氨水浓度变化量表示t1~t2时间内的反应速率为v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s)(用代数式表示);
②若将30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率快(填“快”、“慢”、“相等”或“无法确定”),其原因是a.起始氨水浓度大;b.氨水的体积少,(CaO与H2O)反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.