题目内容
11.能一次区分CH3COOH、CH3CH2OH、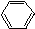 、
、 ,四种物质的是( )
,四种物质的是( )| A. | H2O | B. | Na2CO3溶液 | C. | 石蕊试液 | D. | NaHSO4溶液 |
分析 CH3COOH、CH3CH2OH、C6H6、C6H5NO2四种物质分别与Na2CO3溶液反应的现象为:有气泡冒出、无现象也不分层、分层后油状液体在上层、分层后油状液体在下层,现象不同,可以鉴别,以此来解答.
解答 解:A.CH3COOH、C2H5OH与水混溶,不能鉴别,故A错误;
B.Na2CO3稀溶液与CH3COOH反应产生气体,与C2H5OH混溶,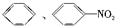 都不溶于水,且苯的密度比水小,硝基苯的密度比水大,可鉴别,故B正确;
都不溶于水,且苯的密度比水小,硝基苯的密度比水大,可鉴别,故B正确;
C.CH3COOH具有酸性,用石蕊试液只能鉴别乙酸,其它物质不反应,无法鉴别,故C错误;
D.CH3COOH、CH3CH2OH与NaHSO4溶液均不反应不分层,现象相同,不能鉴别,故D错误.
故选B.
点评 本题考查有机物的鉴别,注意把握有机物的性质,明确现象不同是鉴别物质的关键,题目难度不大.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
2.下列叙述表示可逆反应N2+3H2?2NH3一定处于平衡状态的是( )
| A. | N2、H2、NH3的百分含量相等 | |
| B. | 单位时间,消耗a mol N2的同时消耗3mol H2 | |
| C. | 单位时间,消耗a molN2的同时生成3a mol H2 | |
| D. | 反应若在定容的密器中进行,压强为反应前的一半 |
6.二氢月桂烯是一种香料中间体,其结构简式如图所示,下列有关二氢月桂烯的说法错误的是( )


| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
16.将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性,溶液中下列微粒的浓度关系正确的是( )
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
5.某实验探究小组用如图1装置来研究影响浓氨水与生石灰反应制氨气的反应速率(实验在通风柜中进行).
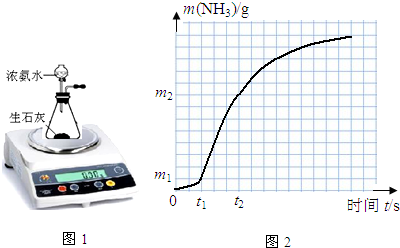
(1)有人认为:既然是以测定氨气的量来求反应速率,装置需再作改进,在上图中画出需改进的装置并注明所盛试剂的名称(不必考虑空气成分的作用).
根据改进后的装置进行实验,通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量可求反应速率v(NH3).为实现如表的实验目的,请完善以下实验方案(c(NH3•H2O)=15mol•L-1、CaO的质量相同、若溶液的体积相同实验过程中温度变化基本相同)和实验结论(填写待测物理量及用字母表示的数据)
(2)根据实验1的结果绘制出如图2反应速率曲线.则
①若忽略溶液体积的变化,以氨水浓度变化量表示t1~t2时间内的反应速率为v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s)(用代数式表示);
②若将30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率快(填“快”、“慢”、“相等”或“无法确定”),其原因是a.起始氨水浓度大;b.氨水的体积少,(CaO与H2O)反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.

(1)有人认为:既然是以测定氨气的量来求反应速率,装置需再作改进,在上图中画出需改进的装置并注明所盛试剂的名称(不必考虑空气成分的作用).
根据改进后的装置进行实验,通过测定产生等质量的NH3所需的时间或相同时间内生成NH3的质量可求反应速率v(NH3).为实现如表的实验目的,请完善以下实验方案(c(NH3•H2O)=15mol•L-1、CaO的质量相同、若溶液的体积相同实验过程中温度变化基本相同)和实验结论(填写待测物理量及用字母表示的数据)
| 实验目的 | V(氨水)/mL | V(H2O)/mL | CaO的状态 | ||
| 实验1 | 实验1和实验2探究固体比表面积、实验1和实验3探究氨水浓度对v(NH3)的影响 | 30 | 粉末状 | ||
| 实验2 | 30 | ||||
| 实验3 | 40 | 0 |
①若忽略溶液体积的变化,以氨水浓度变化量表示t1~t2时间内的反应速率为v(NH3•H2O)=$\frac{25({m}_{2}-{m}_{1})}{17({t}_{2}-{t}_{1})}$mol/(L•s)(用代数式表示);
②若将30mL浓氨水平均分三次加入粉末状CaO中,与实验1相比,0~t1时反应速率快(填“快”、“慢”、“相等”或“无法确定”),其原因是a.起始氨水浓度大;b.氨水的体积少,(CaO与H2O)反应放热使得溶液温度相对较高,反应消耗H2O使得氨水浓度相对较大.
3.表是部分元素在周期表的位置,表中列有①~⑩中元素,用元素符号或化学式填空回答
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为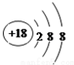
(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3;
(3)写出⑤的最高价氧化物对应水化物与氢氧化钠溶液反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(4)某元素R的气态氢化物为HXR,且R在该氢化物中的质量分数为94%,8.5g的HXR气体在标准状态下的体积是5.6L.则HXR的相对分子量为34;HXR的化学式为H2S.
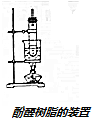 某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下:
某课外活动小组结合一下材料制酚醛树脂,用苯酚和甲醛为原料,在酸或碱的催化作用下缩聚而成,苯酚过量,在酸性催化剂作用下,缩聚成线型结构的热塑性酚醛树脂,甲醛过量,在碱性催化剂作用下,缩聚成体型结构的热固性酚醛树脂设计实验如下: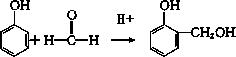
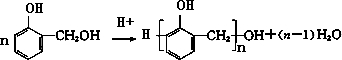
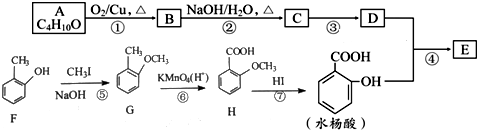
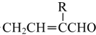
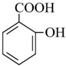 →
→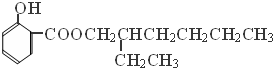 +H2O;
+H2O;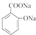
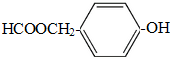 (写结构简式).
(写结构简式).