题目内容
16.按要求完成下列填空:(1)AlCl3溶液蒸干并灼烧得到的物质是Al2O3(填化学式).
(2)泡沫灭火器灭火时发生反应的离子方程是Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)已知25℃时,Ksp[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol•L-1,如要生成Cu(OH)2 沉淀,应调整溶液的pH,使之大于5.
分析 (1)根据AlCl3属于强酸弱碱盐,在溶液中存在水解平衡,氯化铝易水解生成氢氧化铝和HCl,升高温度HCl易挥发,蒸干溶液得到的固体是氢氧化铝,灼烧氢氧化铝,氢氧化铝分解生成氧化铝,所以最终得到的固体是氧化铝;
(2)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体;
(3)根据Ksp=c(Cu2+)•[c(OH-)]2=2×10-20,根据Cu2+离子的浓度计算OH-离子的浓度,根据水的离子积常数计算氢离子浓度,并以此计算溶液pH值;
解答 解:(1)氯化铝为强酸弱碱盐,Al3+发生水解,水解的方程式为Al3++3H2O?Al(OH)3+3H+,水解后溶液呈酸性,蒸干和灼烧过程中,HCl挥发,Al(OH)3不稳定,灼烧时分解生成Al2O3,
故答案为:Al2O3;
(2)硫酸铝和碳酸氢钠能发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,离子方程式为Al3++3HCO3-=Al(OH)3↓+3CO2↑,
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)某CuSO4溶液里c(Cu2+)=0.02mol/L,如果生成Cu(OH)2沉淀,则应有c(OH-)≥$\sqrt{\frac{2×1{0}^{-14}}{0.02}}$mol/L=10-9mol/L,则c(H+)≤$\frac{1×1{0}^{-14}}{1{0}^{-9}}$mol/L=10-5mol/L,
所以pH≥-lg(10-5)=5,所以应调节pH大于5,
故答案为:5;
点评 本题考查盐类水解原理分析、溶液蒸干产物的判断、溶度积常数的计算,题目难度不大,注意把握原理和计算公式的运用.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
6.X、Y、Z是短周期的三种相邻元素,X与Y同主族,Y与Z同周期,已知三种元素族序数之和为16,原子序数之和为38,则X、Y、Z的元素符号为( )
| A. | Na、K、Ca | B. | N、P、S | C. | F、Cl、S | D. | O、S、Cl |
7.“水”电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是( )
| A. | 每生成2mol Na2Mn5O10转移4mol电子 | |
| B. | 正极反应式:Ag+Cl--e-=AgCl | |
| C. | Na+不断向“水”电池的负极移动 | |
| D. | AgCl是还原产物 |
4.下到化学用语表示正确的是( )
| A. | H2O2的电子式: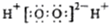 | |
| B. | CH3CH2NO2与H2NCH2COOH互为同分异构体 | |
| C. | 氯乙烷结构简式:CH2ClCH2Cl | |
| D. | C2H4与C3H6一定互为同系物 |
1.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
8.下列说法不正确的是( )
| A. | 电解质在融化状态下一定导电 | |
| B. | 常温下反应NH3(g)+HCl(g)=NH4Cl(s)能进行,则△H<0 | |
| C. | 常温下等pH的强酸HA和弱酸HB的两种溶液中,是的电离同等程度被抑制 | |
| D. | 恒温密闭容器中充入一定量的A进行反应:3A(g)?B(g)+2C(g),达到平衡后,在其它条件不变情况下,再充入一定量的A气体,A的转化率将不变 |
5.下列有关化学用语正确的是( )
| A. | NaOH的电子式: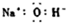 | B. | I4O9(碘酸碘)中碘的化合价为+3,+5 | ||
| C. | NH5的结构式为: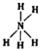 | D. | CO2的比例模型: |
6.二氢月桂烯是一种香料中间体,其结构简式如图所示,下列有关二氢月桂烯的说法错误的是( )


| A. | 分子式:C10H20 | B. | 能使酸性高锰酸钾溶液褪色 | ||
| C. | 能发生加成反应和取代反应 | D. | 所有碳原子均在同一平面 |
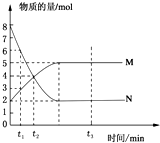 一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为2L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示: