题目内容
6.下列物质的电子式正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、CCS2的电子式类似于CO2,即CS2中的C和S原子间为双键;
B、N原子的最外层有5个电子,其中3个未成对电子和1对成对电子;
C、水为共价化合物;
D、氯化镁为离子化合物,两个氯离子分别与镁离子间存在离子键,且相同的离子不能合并.
解答 解:A、CS2的电子式类似于CO2,电子式为 ,故A错误;
,故A错误;
B、:N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,故B错误;
,故B错误;
C、水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为 ,故C错误;
,故C错误;
D、氯化镁为离子化合物,两个氯离子分别与镁离子间存在离子键,且相同的离子不能合并,故氯化镁的电子式为 ,故D正确.
,故D正确.
故选D.
点评 本题考查了常见的离子化合物和共价化合物电子式的书写,难度不大,应注意的是在书写电子式之前先判断化合物为离子化合物还是共价化合物.

练习册系列答案
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
16.元素的下列性质按C、N、O、F顺序递增的是( )
| A. | 最高正化合价 | B. | 非金属性 | C. | 电子层数 | D. | 原子半径 |
1.下列说法正确的是( )
| A. | 由于水中存在氢键,所以水很稳定 | |
| B. | 能与酸反应生成盐和水的氧化物一定是碱性氧化物 | |
| C. | 单质分子中一定含有共价键 | |
| D. | 由非金属元素组成的化合物不一定是共价化合物 |
11.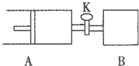 如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
 如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )
如图向A、B中均充入1molX、1moIY,起始时A、B的体积相等都等于aL.在相同温度压强和催化剂存在的条件下,关闭活塞K,使两容器中各自发生下述反应:X(g)+Y(g)?2Z(g)+W(g);△H<0.达平衡时,A的体积为1.4aL.下列说法错误的是( )| A. | 反应速率:v(B)>v(A) | |
| B. | A容器中X的转化率为80% | |
| C. | 平衡时的压强:PB=PA | |
| D. | 平衡时向A容器中充入与反应无关的气体M,能减慢A容器内化学反应的速率 |
18.下列化学用语的表达正确的是( )
| A. | 原子核内有 10 个中子的氧原子:${\;}_{8}^{16}$O | |
| B. | 氢氧根离子的电子式: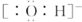 | |
| C. | 基态 Cr 的价电子排布式为:3d44s2 | |
| D. | 某元素原子的电子排布图: |
15.标准状况下,8.0g O2的体积为( )
| A. | 22.4 L | B. | 11.2 L | C. | 8.0 L | D. | 5.6 L |
16.将0.2mol/LCH3COONa与0.1mol/L盐酸等体积混合后,溶液显酸性,溶液中下列微粒的浓度关系正确的是( )
| A. | c(CH3COO-)=c(Cl-)=c(H+)>c(CH3COOH) | B. | c(CH3COO-)=c(Cl-)>c(CH3COOH)=c(H+) | ||
| C. | c(CH3COO-)>c(Cl-)>c(H+)>c(CH3COOH) | D. | c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |