题目内容
18.下列实验设计正确的是( )| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
分析 A、SO2通入溴水褪色是发生氧化还原反应而褪色,体现二氧化硫的还原性;
B、将铁屑放入稀HNO3中是硝酸的强氧化性;
C、将澄清石灰水滴入某溶液有沉淀产生,不能证明其中存在CO32-,还可能存在碳酸氢根离子和亚硫酸根、亚硫酸氢根离子;
D、二氧化硅与焦炭反应生成硅与一氧化碳.
解答 解:A、SO2通入溴水褪色是发生氧化还原反应而褪色,体现二氧化硫的还原性,而不是漂白性,故A错误;
B、将铁屑放入稀HNO3中是硝酸的强氧化性,生成氮的氧化物,而不产生氢气,所以不能证明Fe比H2活泼,故B错误;
C、将澄清石灰水滴入某溶液有沉淀产生,不能证明其中存在CO32-,还可能存在碳酸氢根离子和亚硫酸根、亚硫酸氢根离子,故C错误;
D、二氧化硅与焦炭反应生成硅与一氧化碳,所以石英砂可用于生产单晶硅,故D正确;
故选D.
点评 本题考查化学实验方案的评价,涉及氧化还原反应、单晶硅的制备等,注重物质性质及物质分类的考查,综合性较强,但题目难度不大.

练习册系列答案
相关题目
6.一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+B(g)?2C(g)+D(s)已达到平衡状态的是( )
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥混合气体的总质量
⑦混合气体的总体积.
①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥混合气体的总质量
⑦混合气体的总体积.
| A. | ②③⑤⑥ | B. | ①②③⑤⑥ | C. | ①②③⑤⑦ | D. | ②③④⑤ |
13.在任何条件下,纯水显中性,是因为( )
| A. | PH=7 | B. | c(H+)=c(OH-) | ||
| C. | c(H+)=c(OH-)=10-7mol/L | D. | c(H+)•c(OH-)=10-14 |
10.可用于鉴别以下三种化合物的一组试剂是( )
①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液.

①银氨溶液 ②溴的四氯化碳溶液 ③氯化铁溶液 ④氢氧化钠溶液.
| A. | ②与③ | B. | ③与④ | C. | ①与④ | D. | ①与② |
7.下列转化需要加入氧化剂才能实现的是( )
| A. | H2S SO2 | B. | H2SO4 SO2 | C. | SO2 SO32- | D. | SO32- SO2 |
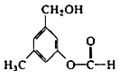 在一定条件下可以发生银镜反应
在一定条件下可以发生银镜反应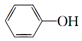 +CO32-→
+CO32-→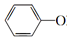 +HCO3-
+HCO3-