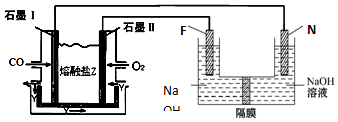
题目内容
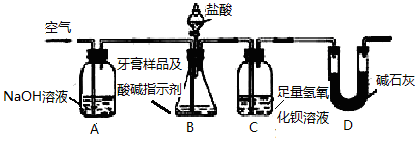
12.根据给出的药品和实验装置,设计一个实验,粗略测定由铜和锌两种金属组成的合金--黄铜中锌的质量分数(黄铜已加工成粉末).药品:稀硫酸、浓硫酸、氧化铜.
实验装置:如图所示,另有托盘天平可用.
根据你设计的实验方案回答下列问题:
(1)你选用的药品是稀硫酸.
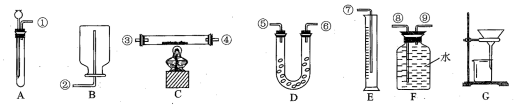
(2)你选用的实验装置有(填装置编号)AEF.若需要组装,则装置连接的顺序是(用装置接口处的编号表示)①⑨⑧⑦(若不需要组装,则不填).
(3)称取a g黄铜粉末样品进行实验,实验中你测定的其他有效数据是A
A、生成H2的体积b L(已折算为标准状况)B、反应前仪器和药品的质量c g
C、反应后剩余固体的质量d gD、反应后仪器和药品的质量e g
(4)计算合金中锌的质量分数$\frac{65b}{22.4a}$×100%.
分析 利用锌与稀硫酸反应生成氢气,并通过排水法测定生成的氢气的体积来计算混合物中的锌的量,从而测定该样品中锌的质量分数,所以选择的仪器连接顺序为①⑨⑧⑦,据此分析解答;
(1)要使锌发生反应生成氢气,则实验时必须用到的化学试剂是稀硫酸;
(2)根据发生装置、排水装置、收集装置进行排序;
(3)根据氢气的体积计算锌的质量,再根据质量分数公式计算锌的质量分数;
(4)称取a g黄铜粉末样品进行实验,测定生成H2的体积b L(折算为标准状况),计算生成氢气物质的量得到合金中锌的物质的量,计算得到质量分数.
解答 解:(1)要想分离铜和锌,只能根据两种金属的活泼性不同,使活泼金属和酸反应,另一种金属和酸不反应,不仅能将两种金属分开,还能根据反应计算锌的质量,则实验时必须用到的化学试剂为稀硫酸,
故答案为:稀硫酸;
(2)选用的实验装置AEF,根据发生装置、排水装置、收集装置进行排序,且排水装置中短管进气长管排水,所以其排列顺序为:AFE,装置接口处的编号表示连接顺序为①⑨⑧⑦,
故答案为:AEF; ①⑨⑧⑦;
(3)称取a g黄铜粉末样品进行实验,实验中你测定的其他有效数据是生成H2的体积b L(已折算为标准状况),故选A,故答案为:A;
(4)称取a g黄铜粉末样品进行实验,实验中你测定的其他有效数据是生成H2的体积b L(已折算为标准状况),Zn+H2SO4=ZnSO4+H2↑,生成氢气物质的量n=$\frac{bL}{22.4L/mol}$=$\frac{b}{22.4}$mol,
合金中锌的质量分数=$\frac{\frac{b}{22.4}mol×65g/mol}{ag}$×100%=$\frac{65b}{22.4a}$×100%,
故答案为:$\frac{65b}{22.4a}$×100%.
点评 本题考查了探究物质的组成或含量的测定,题目难度中等,明确测量原理是解本题关键,注意掌握化学实验基本操作方法及综合应用,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
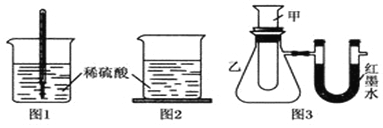
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)方案一中,温度先升高的原因是铝和硫酸反应放出的热量使烧杯里溶液的温度升高,
升至最大值后又逐渐下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(2)方案二中,小木片脱落的原因是氢氧化钠与硫酸的反应放热.
(3)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应.
(4)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
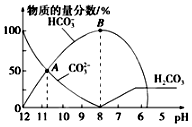 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.
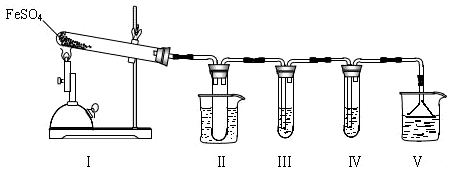
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是A
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为过滤、洗涤、灼烧.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为70%.
| A. | Cl-离子的结构示意图: | B. | HF的电子式: | ||
| C. | 8个中子的碳原子的核素符号:12C | D. | CO2的结构式:O=C=O |
| A. | 氯气不导电,属于非电解质 | |
| B. | 乙酸是有机物,属于非电解质 | |
| C. | 在水溶液和熔融状态下都能够导电的物质才属于电解质 | |
| D. | KCl和Al2O3在熔融状态下均导电,都属于电解质 |