题目内容
13.在任何条件下,纯水显中性,是因为( )| A. | PH=7 | B. | c(H+)=c(OH-) | ||
| C. | c(H+)=c(OH-)=10-7mol/L | D. | c(H+)•c(OH-)=10-14 |
分析 由c(H +)、c(OH-)的相对大小判断溶液的酸碱性,中性时一定存在c(H +)=c(OH-),以此来解答.
解答 解:A.pH=7可能为碱性,如100℃pH=6为中性,故A不选;
B.c(H +)=c(OH -),为中性,故B选;
C.c(H +)=c(OH -),不一定为10-7mol•L-1,常温下等式成立,故C不选;
D.常温下c(H +)×c(OH-)=10-14,不一定为中性,可能为酸、碱、盐溶液,故D不选;
故选B.
点评 本题考查酸碱性的判断,为高频考点,把握酸碱性判断的方法为解答的关键,侧重分析与应用能力的考查,注意氢离子浓度、Kw与温度的关系,题目难度不大.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
3.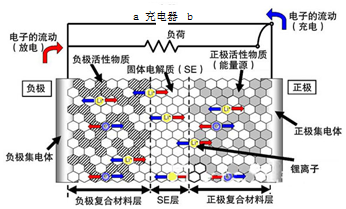 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
 新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )
新一代全固体锂离子电池使用硫化物固体电解质,利用薄层成膜技术和加压成型技术,提高了材料颗粒间的离子传导性,从而实现了无需机械加压的充放电.电池的工作原理为:LiMO2+nC$?_{充电}^{放电}$ Li1-xMO2+LixCn (M可以是Co、Ni、Fe等),内部结构如图所示.下列有关说法正确的是( )| A. | 电池放电时,负极发生的反应为:nC+xLi++xe-═LixCn | |
| B. | 充电器的a端接电源的负极,b端接电源的正极 | |
| C. | 电池充电时Li+自左向右移动 | |
| D. | 电池工作时,固体电解质因熔融而导电 |
4.O2和O3是氧元素的两种结构不同的单质,1mol O2转化为O3时要吸收94.73kJ的热能.下列说法正确的是( )
| A. | O3比O2稳定 | |
| B. | O2和O3是氧的两种核素,互称同素异形体 | |
| C. | O2和O3的相互转化是化学变化 | |
| D. | 在标准状况下,等体积的O2和O3含有相同数目的氧原子 |
1.元素在周期表中的位置反映了元素的性质.第3周期元素中,原子半径最大的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
8.下列化合物不能由单质直接化合而成的是( )
| A. | FeCl3 | B. | CuS | C. | HCl | D. | Fe3O4 |
18.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
5.一定条件下的可逆反应2NO2 (红棕色)?2NO (无色)+O2 (无色),在恒压密闭容器充入NO2,达到化学平衡状态的标志是( )
| A. | 反应停止了 | |
| B. | NO的正反应速率与O2的逆反应速率相等 | |
| C. | c(NO):c(O2)=2:1 | |
| D. | 气体的颜色不再变化 |
2.下列关于晶体的说法,不正确的是( )
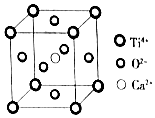
( Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)

( Ti4+位于顶点上,O2-位于面心上,Ca2+位于中心)
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 该晶体中每个Ti4+和8个O2-相紧邻 | |
| C. | 一个CO2晶胞中平均含有4个CO2分子 | |
| D. | 金属晶体的熔点可能比分子晶体的熔点低 |
7.某研究小组经查阅资料得知:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO3↑+SO2↑;FeSO4$\frac{\underline{\;高温\;}}{\;}$FeO+SO3↑,SO3的熔点是16.8℃,沸点是44.8℃.
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.
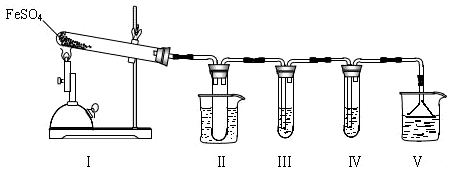
(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
Ⅱ.FeSO4固体往往含有Fe2(SO4)3杂质,该研究小组采用称重法确定固体中铁元素的质量分数,操作流程为:

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是A
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为过滤、洗涤、灼烧.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为70%.
I.该小组探究在酒精喷灯加热条件下FeSO4分解的气体产物,实验装置如图所示.

(1)装置Ⅱ的试管中不装任何试剂,其作用是防止溶液倒吸入装置Ⅰ中(或安全瓶),试管浸泡在50℃的水浴中,目的是防止SO3液化或凝固.
(2)装置Ⅲ和装置Ⅳ的作用是探究本实验气体产物成分.请完成实验设计,填写检验试剂、预期现象与结论.
限选试剂:3mol•L-1 H2SO4溶液、6mol•L-1 NaOH溶液、0.5mol•L-1 BaCl2溶液、0.5mol•L-1 Ba(NO3)2溶液、0.01mol•L-1酸性KMnO4溶液、0.01mol•L-1溴水.
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

请根据流程回答:
(1)操作Ⅱ中必须用到的仪器是A
A.25mL酸式滴定管 B.50mL 量筒 C.25mL 量筒 D.25mL碱式滴定管
(2)系列操作名称依次为过滤、洗涤、灼烧.
(3)若最终测得红棕色固体质量为3.2g,则样品中铁元素的质量分数为70%.