题目内容
6.一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+B(g)?2C(g)+D(s)已达到平衡状态的是( )①混合气体的压强
②混合气体的密度
③B的物质的量浓度
④混合气体总物质的量
⑤混合气体的平均相对分子质量
⑥混合气体的总质量
⑦混合气体的总体积.
| A. | ②③⑤⑥ | B. | ①②③⑤⑥ | C. | ①②③⑤⑦ | D. | ②③④⑤ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①两边气体的计量数相等,混合气体的压强始终不变,故错误;
②混合气体的密度,说明气体的质量不变,反应达平衡状态,故正确;
③B的物质的量浓度,说明正逆反应速率相等,反应达平衡状态,故正确;
④两边气体的计量数相等,混合气体总物质的量始终不变,故错误;
⑤混合气体的平均相对分子质量不变,说明气体的质量不变,反应达平衡状态,故正确;
⑥混合气体的总质量不变,说明正逆反应速率相等,反应达平衡状态,故正确;
⑦气体的总物质的量不变,所以混合气体的总体积是一个定值,所以不一定是平衡状态,故错误;
故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
相关题目
16.已知X、Y、Z、W、R是元素周期表中前四周期的常见元素,相关信息如表所述:
(1)R在元素周期表中的位置为第四周期第VIII族,X的基态原子的价电子排布图为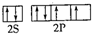 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.
(2)用“>”、“<”或“=”填空:
(3)用方程式表示下列过程:
①Y的气态氢化物的水溶液遇酚酞变红的原因NH3•H2O?NH4++OH-,
②W的最高价氧化物的水化物在水中发生电离H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
| 元素 | 相关信息 |
| X | 地壳中含量最多的元素 |
| Y | 元素的气态氢化物极易溶于水,水溶液遇酚酞变红 |
| Z | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物是自来水生产过程中常用的消毒剂 |
| W | 与Z同周期,第一电离能至第四电离能分别是:I1=578kJ•mol-1,I2=1817kJ•mol-1,I3=2745kJ•mol-1,I4=11575kJ•mol-1 |
| R | 有多种化合价,水溶液中其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
 ,Z的基态原子的电子排布式为1s22s22p63s23p5.
,Z的基态原子的电子排布式为1s22s22p63s23p5.(2)用“>”、“<”或“=”填空:
| 简单离子半径 | 第一电离能 | 电负性 | 气态氢化物稳定性 |
| X<Y | X<Y | X>Z | H2X>YH3 |
①Y的气态氢化物的水溶液遇酚酞变红的原因NH3•H2O?NH4++OH-,
②W的最高价氧化物的水化物在水中发生电离H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
17.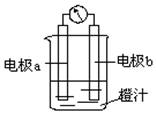 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A. | a为镁条、b为锌片时,镁条为负极 | |
| B. | a为镁条、b为锌片时,橙汁中阳离子移向b电极 | |
| C. | a为锌片、b为铜片时,铜极上发生还原反应 | |
| D. | a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
14.下列过程发生化学变化的是( )
| A. | 蒸馏 | B. | 将固体碘单质升华 | ||
| C. | 用液氨做制冷剂 | D. | 加热硫酸铜晶体失水 |
1.元素在周期表中的位置反映了元素的性质.第3周期元素中,原子半径最大的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
11.实现下列物质间的转化,需加入还原剂的是( )
| A. | SO2→SO3 | B. | Na2SO3→SO2 | C. | SO2→S | D. | H2S→S |
18.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
15.设NA表示阿伏加德罗常数的值,下列叙述中对应的值为 NA的是( )
| A. | 30 g由乙酸和乳酸组成的混合物中所含有的O原子数 | |
| B. | Cu和足量的稀硝酸反应产生7.47 L NO气体时转移的电子数 | |
| C. | 0.25 mol丁烷中含有的非极性键数 | |
| D. | 1 mol FeCl3加入沸水制得的胶体中含有胶体粒子数 |
16.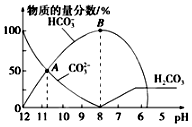 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
 常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )
常温下,向20mL0.1mol•L-1 Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液40mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量浓度的百分含量随溶液pH变化的情况如图所示.下列说法正确的是( )| A. | A点所处的溶液中c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| B. | 随着盐酸的加入,溶液中$\frac{c(HC{O}_{3}^{-})c(O{H}^{-})}{c(C{O}_{3}^{2-})}$将减小 | |
| C. | 随着盐酸的加入,当pH约为6时,溶液中开始放出气体 | |
| D. | 当溶液的pH为7时,溶液的总体积为40mL |