题目内容
9.已知25℃、101kPa下,断开1mol H2中的化学键需吸收436kJ的热量,断开1mol Cl2中的化学键需吸收243kJ的热量,断开1mol HCl分子中的化学键需吸收431kJ的热量,试求5mol H2和5mol Cl2完全反应的能量变化为放出915kJ(填“吸收或放出”+能量数值).分析 依据化学反应反应H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2HCl的焓变=反应物键能总和-生成物键能总和计算出其焓变,然后可得出5mol H2和5mol Cl2完全反应的能量变化.
解答 解:反应H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$2HCl的焓变=反应物键能总和-生成物总和=436kJ/mol+243kJ/mol-2×431kJ/mol=-183kJ/mol,
该反应为放热反应,则5mol H2和5mol Cl2完全反应放出热量为:183kJ/mol×5mol=915kJ,
故答案为:放出915.
点评 本题考查反应热与焓变的简单应用,题目难度不大,明确焓变=反应物键能总和-生成物总和为解答关键,注意掌握化学反应与能量变化的关系,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
10.下列实验方案不能达到实验目的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反产生的气体通入溴的四氯化碳溶液 |
| B | 检验卤代烃中卤原子的种类 | 将溴乙烷与氢氧化钠溶液共热,取冷却后反应液 滴加硝酸酸化后滴加硝酸银溶液 |
| C | 验证乙炔能被酸性高锰酸钾溶液氧化 | 将电石与饱和食盐水反应生成的气体通入酸性高锰酸钾溶液,观察溶液是否褪色 |
| D | 验证苯和液溴在FeBr3的催化下发生取代反应 | 将反应产生的混合气体先通入溴的四氯化碳溶液再通入AgNO3溶液中,观察是否有淡黄色沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
17.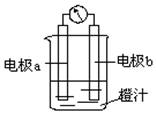 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
 利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )
利用镁条、锌片、铜片、导线、电流计、橙汁、烧杯等用品和如图装置,探究原电池的原理.下列结论错误的是( )| A. | a为镁条、b为锌片时,镁条为负极 | |
| B. | a为镁条、b为锌片时,橙汁中阳离子移向b电极 | |
| C. | a为锌片、b为铜片时,铜极上发生还原反应 | |
| D. | a为锌片、b为铜片时,电子由铜片通过导线流向锌片 |
4.O2和O3是氧元素的两种结构不同的单质,1mol O2转化为O3时要吸收94.73kJ的热能.下列说法正确的是( )
| A. | O3比O2稳定 | |
| B. | O2和O3是氧的两种核素,互称同素异形体 | |
| C. | O2和O3的相互转化是化学变化 | |
| D. | 在标准状况下,等体积的O2和O3含有相同数目的氧原子 |
14.下列过程发生化学变化的是( )
| A. | 蒸馏 | B. | 将固体碘单质升华 | ||
| C. | 用液氨做制冷剂 | D. | 加热硫酸铜晶体失水 |
1.元素在周期表中的位置反映了元素的性质.第3周期元素中,原子半径最大的是( )
| A. | Na | B. | Si | C. | S | D. | Cl |
18.下列实验设计正确的是( )
| A. | 将SO2通入溴水中证明SO2具有漂白性 | |
| B. | 将铁屑放入稀HNO3中证明Fe比H2活泼 | |
| C. | 将澄清石灰水中滴入某溶液后生成沉淀,说明滴入的溶液中含大量CO${\;}_{3}^{2-}$ | |
| D. | 石英砂可用于生产单晶硅 |
19.某同学设计如下三个实验方案以探究某反应是放热反应还是吸热反应:
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.
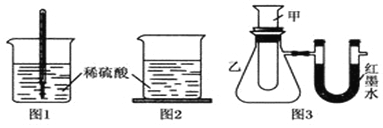
方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
根据上述实验回答相关问题:
(1)方案一中,温度先升高的原因是铝和硫酸反应放出的热量使烧杯里溶液的温度升高,
升至最大值后又逐渐下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(2)方案二中,小木片脱落的原因是氢氧化钠与硫酸的反应放热.
(3)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应.
(4)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
方案一:如图1,在小烧杯里放一些除去氧化铝保护膜的铝片,然后向烧杯里加入10mL 2mol•L-1稀硫酸,再插入一支温度计,温度计的温度由20℃逐渐升至35℃,随后,温度逐渐下降至30℃,最终停留在20℃.
方案二:如图2,在烧杯底部用熔融的蜡烛粘一块小木片,在烧杯里加入10mL 2mol•L-1硫酸溶液,再向其中加入氢氧化钠溶液,片刻后提起烧杯,发现小木片脱落下来.

方案三:如图3,甲试管中发生某化学反应,实验前U形管红墨水液面相平,在化学反应过程中,通过U形管两侧红墨水液面高低判断某反应是吸热反应还是放热反应.
| 序号 | 甲试管里发生反应的物质 | U形管里红墨水液面 |
| ① | 氧化钙与水 | 左低右高 |
| ② | 氢氧化钡晶体与氯化铵晶体(充分搅拌) | ? |
| ③ | 铝片与烧碱溶液 | 左低右高 |
| ④ | 铜与浓硝酸 | 左低右高 |
(1)方案一中,温度先升高的原因是铝和硫酸反应放出的热量使烧杯里溶液的温度升高,
升至最大值后又逐渐下降的原因是反应完全后,热量向空气中传递,烧杯里物质的温度降低.
(2)方案二中,小木片脱落的原因是氢氧化钠与硫酸的反应放热.
(3)由方案三的现象得出结论:①③④组物质发生的反应都是放热(填“吸热”或“放热”)反应.
(4)方案三实验②的U形管中的现象为红墨水液面左高右低,说明反应物的总能量小于(填“大于”“小于”或“等于”)生成物的总能量.
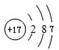 ;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.
;D微粒的核外电子排布式为1s2 2s22p6 3s23p6.