题目内容
12.将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7,Ka2=4.7×10-11.则NH4HCO3溶液呈碱性(填“酸性”、“中性”或“碱性”)分析 已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,所以碳酸氢根离子的水解能力强于铵根离子,据此判断碳酸氢铵的酸碱性.
解答 解:已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,由于碳酸氢根离子的水解能力强于铵根离子,所以NH4HCO3显碱性,
故答案为:碱性.
点评 本题考查了盐的水解原理,题目难度不大,明确酸性、碱性强弱与盐的水解程度大小的关系为解答关键,注意掌握盐的水解原理及其影响因素,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
2.下列物质之间的转化,需要加入适当的氧化剂才能完成的是( )
| A. | SO3→H2SO4 | B. | HNO3→NO | C. | Fe→FeCl2 | D. | Cl2→HClO |
7.NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 反应3Fe2++2S2O32-+O2+4OH-=Fe3O4+S4O62-+2H2O中,每生成1molFe3O4时,转移电子数为4NA | |
| B. | 常温常压下,2.24LCO2的质量大于4.4g | |
| C. | 常温下,1L0.1mol•L-1AlCl3溶液中阳离子数目小于0.1NA | |
| D. | 15.6gNa2O2和Na2S固体混合物中,含有阴离子数目大于0.2NA |
17.若发现116号元素X,其不完整的原子结构示意图为 则下列预测正确的是( )
则下列预测正确的是( )
 则下列预测正确的是( )
则下列预测正确的是( )| A. | 该单质很难与其他物质发生反应 | B. | 其最高价氧化物的化学式为XO3 | ||
| C. | 第三层的电子数为8个 | D. | 元素X是一种非金属元素 |
16.氨水是实验室中的常用试剂.某课外活动小组欲通过实验测定NH3•H2O的电离常数.
【讨论】选用以下试剂和仪器:浓度大约为0.1mol/L的氨水、0.1000mol/L盐酸、甲基橙、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、烧杯、pH计、铁架台
在组装仪器是发现缺少了一种仪器,缺少的仪器是滴定管夹.添加这种仪器后进行实验.
【实验过程】
【反思】:该小组在实验条件下测得氨水的电离常数K=1.60×10-5.查阅资料得知:25℃时氨水的电离常数K=1.75×10-5.检查滴定过程操作、计算均没有错误,该小组讨论后认为实验测得氨水的电离常数是准确的,但是应该补充一项实验内容,补充的实验内容是测定氨水的温度.
【拓展应用】25℃时,pH=5的氯化铵溶液中$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=0.175.(写出推导过程并计算出结果)
【讨论】选用以下试剂和仪器:浓度大约为0.1mol/L的氨水、0.1000mol/L盐酸、甲基橙、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、烧杯、pH计、铁架台
在组装仪器是发现缺少了一种仪器,缺少的仪器是滴定管夹.添加这种仪器后进行实验.
【实验过程】
| 实验步骤 | 实验目的 |
| (滴定前的所有操作正确,已略去) 步骤1: ①用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙. ②用酸式滴定管取0.1000mol/L盐酸滴定氨水. ③当锥形瓶中的溶液由黄色变成橙色时,停止滴定,纪录数据. ④重复滴定操作2~3次. | 测定氨水的准确浓度 |
| 步骤2:用pH计测定氨水的pH. | 测定氨水中c(OH-)浓度 |
| 步骤3:通过实验数据计算氨水的电离常数K | |
【拓展应用】25℃时,pH=5的氯化铵溶液中$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=0.175.(写出推导过程并计算出结果)
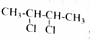 为原料制备某五元环化合物的流程如图所示:
为原料制备某五元环化合物的流程如图所示: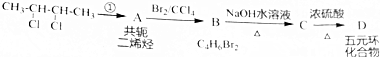
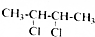 的系统命名为2,3-二氯丁烷.
的系统命名为2,3-二氯丁烷.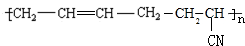 等.
等.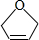 .
.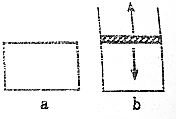 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.