题目内容
16.氨水是实验室中的常用试剂.某课外活动小组欲通过实验测定NH3•H2O的电离常数.【讨论】选用以下试剂和仪器:浓度大约为0.1mol/L的氨水、0.1000mol/L盐酸、甲基橙、蒸馏水、酸式滴定管、碱式滴定管、锥形瓶、胶头滴管、烧杯、pH计、铁架台
在组装仪器是发现缺少了一种仪器,缺少的仪器是滴定管夹.添加这种仪器后进行实验.
【实验过程】
| 实验步骤 | 实验目的 |
| (滴定前的所有操作正确,已略去) 步骤1: ①用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙. ②用酸式滴定管取0.1000mol/L盐酸滴定氨水. ③当锥形瓶中的溶液由黄色变成橙色时,停止滴定,纪录数据. ④重复滴定操作2~3次. | 测定氨水的准确浓度 |
| 步骤2:用pH计测定氨水的pH. | 测定氨水中c(OH-)浓度 |
| 步骤3:通过实验数据计算氨水的电离常数K | |
【拓展应用】25℃时,pH=5的氯化铵溶液中$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=0.175.(写出推导过程并计算出结果)
分析 【讨论】根据酸碱中和滴定的实验操作分析;
【实验过程】步骤1:
①在锥形瓶中加待测溶液;
②取盐酸滴定氨水;
③达到滴定终点时溶液由氨水变为氯化铵;
④重复滴定操作2~3次;
步骤2:准确测定氨水的pH,以便计算氨水中氢氧根离子浓度;
步骤3:通过实验数据计算氨水的电离常数K;
【反思】:电离常数只与温度有关,要测定氨水的温度;
【拓展应用】根据溶液中氢离子浓度,结合电离常数和水的离子积计算.
解答 解:【讨论】酸碱中和滴定的实验需要的仪器有:酸式滴定管、碱式滴定管、锥形瓶、铁架台、滴定管夹;
故答案为:滴定管夹;
【实验过程】步骤1:
①在锥形瓶中加待测溶液,即用碱式滴定管量取20.00mL的氨水放入锥形瓶中,滴入2滴甲基橙;
②用酸式滴定管取0.1000mol/L盐酸,然后滴定氨水;
③达到滴定终点时溶液由氨水变为氯化铵,溶液中颜色变化为由黄色变为橙色;
④为了提高测定结果的准确性,要重复滴定操作2~3次;
步骤2:用pH计准确测定氨水的pH,以便计算氨水中氢氧根离子浓度;
步骤3:通过实验数据计算氨水的电离常数K;
故答案为:
| 实验步骤 | 实验目的 |
| 步骤1:②用酸式滴定管取0.1000mol/L盐酸滴定氨水 ③黄; ④重复滴定操作2~3次 | |
| 步骤2:用pH计测定氨水的pH | 测定氨水中c(OH-)浓度 |
【反思】:测得氨水的电离常数K=1.60×10-5,查阅资料得知:25℃时氨水的电离常数K=1.75×10-5.电离常数只与温度有关,电离常数不同,说明溶液的温度波动,所以要测定氨水的温度;
故答案为:测定氨水的温度;
【拓展应用】25℃时,pH=5的氯化铵溶液中c(H+)=10-5mol/L,$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c({H}^{+})×c(N{{H}_{4}}^{+})×c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)×c(O{H}^{-})}$=$\frac{K}{{K}_{w}}$×c(H+)=$\frac{1.75×1{0}^{-5}}{1{0}^{-14}}×(1{0}^{-5})^{2}$=0.175;
故答案为:0.175.
点评 本题考查了酸碱中和滴定实验、电离常数的有关计算等,题目难度中等,注意把握中和滴定实验原理和电离常数、离子积常数的计算公式和应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
7.液氨与水的电离相似,存在着微弱的电离:2NH3?NH4++NH2-.对该体系的说法中正确的是( )
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |
4.在室温下,100ml 0.1mol/L的醋酸溶液中,欲使其溶液的pH值减小,但又要使醋酸电离程度减少,应采取( )
| A. | 加入少量CH3COONa固体 | B. | 通入少量氯化氢气体 | ||
| C. | 提高温度 | D. | 加入大量水 |
11.在配制一定物质的量浓度的盐酸时,下列错误操作可使所配制溶液的浓度偏高的是( )
| A. | 用量筒量取浓盐酸时俯视量筒刻度进行读数 | |
| B. | 定容时俯视容量瓶瓶颈刻度线 | |
| C. | 溶解搅拌时有液体飞溅 | |
| D. | 摇匀后见液面下降,再加水至刻度线 |
8.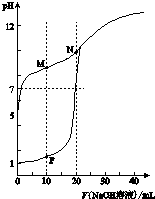 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |
6.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |