题目内容
4.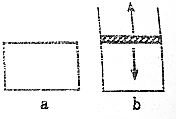 已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.
已知2N02?N2O4△H<0.将N02充入容易导热的材料制成的容器a和b中进行反应,a的容积保持不变,b的上盖可随容器内气体压强的改变而上下移动,以保持容器内外压强相等.当同温同压时,将等量的NO2充入“起始态”体积相同的容器a、b中,反应同时开始.(1)反应开始时,a与b中生成N2O4的速率Va等于Vb.
(2)反应过程中两容器里生成N2O4的速率是Va<Vb.
(3)达到平衡时,a与b中N02转化为N2O4的百分数(A)相比较,则是Aa<Ab.
分析 (1)反应起始时,两容器中NO2的浓度相等;、
(2)因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在反应过程中B的压强大于A,压强大反应速率也大,据此判断;
(3)因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在达到平衡时,B的压强大于A,B容器中反应正向进行的程度大于A,所以NO2的转化率大小关系是:Aa<Ab;
解答 解:(1)反应起始时,两容器中NO2的浓度相等,所以两容器中生成N2O4的速率关系是Va=Vb,故答案为:等于;
(2)因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在反应过程中B的压强大于A,压强大反应速率也大,所以生成N2O4的速率关系是Va<Vb,故答案为:<;
(3)因为该反应是体积减小的反应,B是恒压,而A是恒容,所以在达到平衡时,B的压强大于A,B容器中反应正向进行的程度大于A,所以NO2的转化率大小关系是:Aa<Ab,故答案为:<.
点评 本题主要考查了影响化学平衡移动的因素等知识点,难度不大,解的关键是要注意两容器一个是恒容一个恒压的区别.

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
15.0.1mo1•L-1的CH3COOK溶液中,由于CH3COO-的水解,使得c(CH3C00-)<0.1mol•L-1.如果要使c(CH3C00-)更接近于0.1mo1•L-1,可以采取的措施是( )
| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |
19.在一定条件下,可以用如图(1)所示的硼化钒(VB2)-空气电池气(工作时反应为:4VB2+11O2=4B2O3+2V2O5)为电源给图(2)所示装置通电,模拟有机物的电化学储氢.下列说法正确的是( )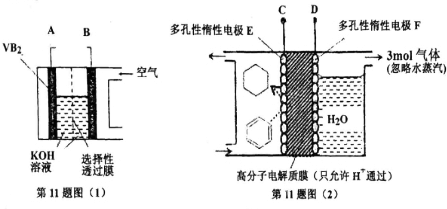

| A. | 整套装置工作时的连接为A连接D、B连接C | |
| B. | VB2极发生的电极反应为:2VB2+22OH--22e-=V2O5+2B2O3+11H2O | |
| C. | 电极F产生3mol气体时电极E得到的氧化产物为2mol | |
| D. | 储氢装置工作时,右侧电极区的pH值减小 |
7.液氨与水的电离相似,存在着微弱的电离:2NH3?NH4++NH2-.对该体系的说法中正确的是( )
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |
8.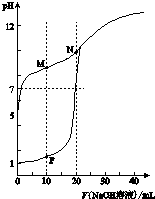 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
 温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )
温室下,用0.1mol•L-1NaOH溶液分别滴定体积均为20ml浓度均为0.1mol•L-1HCl溶液和HX溶液,溶液的pH随加入NaOH溶液体积变化图,下列说法不正确的是( )| A. | HX为弱酸 | |
| B. | M点c(HX)-c(X-)>c(OH-)-c(H+) | |
| C. | 将P点和N点的溶液为混合,呈酸性 | |
| D. | 向N点溶液中通入HCl至pH=7:c(Na+)>c(HX)=c(Cl-)>c(X-) |