题目内容
3.现有7.3gHCl气体.(1)该气体在标准状况下的体积为4.48L.
(2)该气体溶于1L水中,其溶液中溶质的质量分数为0.72%.
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为$\frac{0.2}{V}$mol•L-1.
(4)该气体在标准状况下的密度为1.63g•L-1.
分析 (1)结合n=$\frac{m}{M}$=$\frac{V}{{V}_{m}}$计算;
(2)溶于1L水中,溶液质量为(7.3+1000)g,溶质质量为7.3 g,溶液质量分数=$\frac{溶质质量}{溶液质量}$×100%;
(3)根据c=$\frac{n}{V}$计算溶液物质的量浓度;
(4)标况下,气体的密度ρ=$\frac{M}{{V}_{m}}$,据此计算.
解答 解:(1)n(HCl)=$\frac{m}{M}$=$\frac{7.3g}{36.5g/mol}$=0.2mol,V(HCl)=0.2mol×22.4L/mol=4.48L,
故答案为:4.48;
(2)溶于1L水中,溶液质量为(7.3+1000)g,溶质质量为7.3 g,溶质的质量分数为$\frac{7.3}{1007.3}$×100%≈0.72%,
故答案为:0.72%;
(3)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为c=$\frac{n}{V}$=$\frac{0.2mol}{VL}$=$\frac{0.2}{V}$mol/L,
故答案为:$\frac{0.2}{V}$;
(4)气体摩尔质量为 71g/mol,故标况下,该气体的密度ρ=$\frac{M}{{V}_{m}}$=$\frac{71}{22.4}$g/L≈1.63g/L,
故答案为:1.63.
点评 本题考查物质量的计算,为高频考点,侧重于学生的计算能力的考查,注意相关计算公式的运用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.如表是甲同学研究氯水性质实验片段的活动记录.
(1)根据上述实验内容和现象,选择合理解释填到表中(填序号)
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.
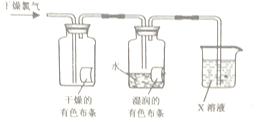
回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
| 实验内容 | 实验现象 | 解释及结论 |
| 观察氯水的颜色、状态 | 呈黄绿色 | ① C |
| 向氯水中滴入几滴硝酸银溶液 | 有白色沉淀 | ② A |
| 用玻璃棒蘸取氯水,点在蓝色石蕊试纸上 | 滴有氯水的试纸中间变白,外圈变红 | ③ B |
A.氯化中存在Cl-
B.氯水中有漂白性物质和酸性物质
C.氯水中存在Cl2分子
(2)甲同学在实验中运用了AD进行探究(填序号)
A.观察法 B.比较法 C.分类法 D.实验法
(3)乙同学在甲同学的实验基础上设计了如图实验装置进一步研究氯气的性质.

回答下列问题:
①实验中,乙同学观察到干燥的有色布条不褪色,湿润的有色布条褪色,得出的实验结论是干燥氯气没有漂白性.
②为了防止多余的氯气污染空气,实验室常用X溶液来吸收尾气,写出X的化学式NaOH.
11.关于有机物的下列说法中,正确的是( )
| A. | 所有醇和卤代烃都能发生消去反应 | |
| B. | 甲苯能使溴水因化学反应褪色而苯不能 | |
| C. | 苯酚在70℃水中溶解度不大 | |
| D. | 低级酯的密度一般小于水 |
18.实验室中,用AlCl3制取氢氧化铝,最适宜用的试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | Ba(OH)2溶液 | D. | 盐酸 |
15.0.1mo1•L-1的CH3COOK溶液中,由于CH3COO-的水解,使得c(CH3C00-)<0.1mol•L-1.如果要使c(CH3C00-)更接近于0.1mo1•L-1,可以采取的措施是( )
| A. | 加入少量盐酸 | B. | 加入适量的水 | C. | 加入适量的KOH | D. | 加热 |
7.液氨与水的电离相似,存在着微弱的电离:2NH3?NH4++NH2-.对该体系的说法中正确的是( )
| A. | 液氨中c(NH4+)与c(NH2-)的乘积总为一定值 | |
| B. | 液氨的电离达到平衡时,c(NH3)=c(NH4+)=c(NH2-) | |
| C. | 只要不加入其它物质,液氨中c(NH4+)与c(NH2-)总是相等 | |
| D. | 液氨中含有NH3、NH4+、NH2-、H2O、NH3•H2O等微粒 |