题目内容
7.现有常温时pH=1的某强酸溶液10mL,下列操作能使溶液的pH变成2的是( )| A. | 加水稀释成100 mL | B. | 加入10 mL的水进行稀释 | ||
| C. | 加入10 mL 0.01 mol/L的NaOH溶液 | D. | 加入10 mL 0.01 mol/L的HCl溶液 |
分析 常温下pH=1的某强酸溶液中c(H+)=0.1mol/L,使溶液的pH变成2,即c(H+)=0.01mol/L,可加水稀释或加入一定量的碱进行中和,使溶液中c(H+)=0.01mol/L即可,据此进行解答.
解答 解:常温下pH=1的某强酸溶液中c(H+)=0.1mol/L,使溶液的pH变成2,此时溶液中c(H+)=0.01mol/L,
A.加水稀释成100mL,稀释后的溶液中c(H+)=$\frac{0.001mol}{0.1L}$=0.01mol/L,故A正确;
B.加入10mL的水进行稀释,混合后溶液中c(H+)=$\frac{0.01mol}{0.02L}$=0.05mol/L≠0.01mol/L,故B错误;
C.pH=1的某强酸溶液10mL,n(H+)=0.01L×0.1mol/L=0.001mol,10mL0.01mol/L的NaOH溶液,n(OH-)=0.01L×0.01mol/L=0.0001mol,混合后c(H+)=$\frac{0.01mol-0.001mol}{0.02L}$≠0.01mol/L,故C错误;
D.加入10mL0.01mol/L的盐酸,混合后,c(H+)=$\frac{0.01mol+0.01L×0.01mol/L}{0.02L}$≠0.01mol/L,故D错误;
故选A.
点评 本题考查酸碱混合的计算和判断,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握pH的概念及表达式,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
17.某化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ~Ⅳ所示.下列有关评价正确的是( )
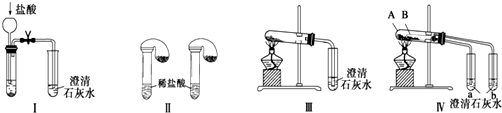

| A. | 根据图Ⅰ所示实验,可以根据澄清石灰水是否变浑浊鉴别碳酸钠和碳酸氢钠固体 | |
| B. | 在图Ⅱ所示实验的左右两只试管中加入足量的盐酸,然后向两个气球中分别加入等物质的量的碳酸钠和碳酸氢钠固体,根据反应后气球的大小可鉴别两种固体 | |
| C. | 与实验Ⅲ相比,实验Ⅳ的突出优点是可以做到用一套装置同时进行两个对比实验,而Ⅲ不行 | |
| D. | 若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则小试管B中装入的固体是碳酸钠 |
18.下列有关钠、铁、铝性质的说法中不正确的是( )
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,但金属钠与盐酸的反应最剧烈 | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁单质 | |
| D. | 钠、铝均能与NaOH溶液反应,但参加反应的物质种类前者少于后者 |
2.某温度下,一定量Cl2和100mL2mol/L氢氧化钠溶液恰好完全反应,生成的NaClO、NaClO3物质的量之比为1:3,则被还原的氯元素的质量为( )
| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
12.下列实验过程中,始终无明显现象的是( )
| A. | NO2通入FeSO4溶液中 | B. | CO2通入CaCl2溶液中 | ||
| C. | Cl2通入Na2CO3溶液中 | D. | SO2通入酸化的Ba(NO3)2溶液中 |
19.一定量的铝溶于一定浓度的硝酸的反应中,产生标准状况下的NO气体11.2L,在所得溶液中加入足量的氨水,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为( )
| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
16.下列说法正确的是( )
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(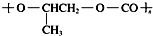 )可由单体环氧丙烷( )可由单体环氧丙烷(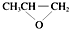 )和CO2缩聚制得 )和CO2缩聚制得 |
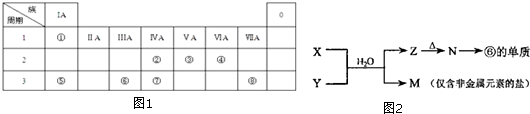
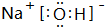 ;
;
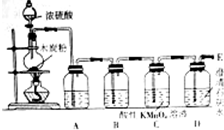 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题: