题目内容
8.下列大小关系正确的是( )| A. | 熔点:HI<HBr | B. | 硬度:MgO>CaO | ||
| C. | 晶格能:NaCl<NaBr | D. | 熔沸点:CO2>NaCl |
分析 A.均为分子晶体,且不存在氢键,相对分子质量越大熔点越高;
B.离子键越强硬度越大,离子所带电荷越多、离子半径越小,离子键越强;
C.离子所带电荷越多、离子半径越小,晶格能越大;
D.CO2形成分子晶体,NaCl属于离子晶体.
解答 解:A.HI、HBr均为分子晶体,且不存在氢键,HF相对分子质量更大,分子间作用力更强,故HI的熔点更高,故A错误;
B.离子所带电荷相同,Mg2+离子半径小于Ca2+离子半径,MgO晶体中离子键更稳定,则硬度:MgO>CaO,故B正确;
C.离子所带电荷相同,Cl-离子半径小于Br-离子半径,则晶格能:NaCl>NaBr,故C错误;
D.CO2形成分子晶体,NaCl属于离子晶体,离子晶体熔沸点大于分子晶体,故熔沸点:CO2<NaCl,故D错误,
故选:B.
点评 本题考查熔沸点高低比较、晶格能、晶体类型与性质,关键是理解掌握晶体类型与熔沸点、硬度关系及判断方法,分子晶体熔沸点与分子间作用力和氢键有关.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
18.下列有关钠、铁、铝性质的说法中不正确的是( )
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,但金属钠与盐酸的反应最剧烈 | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁单质 | |
| D. | 钠、铝均能与NaOH溶液反应,但参加反应的物质种类前者少于后者 |
19.一定量的铝溶于一定浓度的硝酸的反应中,产生标准状况下的NO气体11.2L,在所得溶液中加入足量的氨水,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为( )
| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
16.下列说法正确的是( )
| A. | C2H6与C3H8没有同分异构体,CH2O2与C2H4O2属于同系物 | |
| B. | 一定条件下,乙酸乙酯、淀粉、蛋白质、乙烯都能与水发生水解反应 | |
| C. | 一定条件下,完全燃烧14g含氧质量分数为a的乙烯、乙醛混合气体,则生成水的质量为18(1-a)g | |
| D. | 全降解塑料(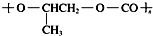 )可由单体环氧丙烷( )可由单体环氧丙烷(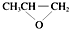 )和CO2缩聚制得 )和CO2缩聚制得 |
3.下列物质中属于电解质并能导电的是( )
| A. | 液态氢氧化钾 | B. | 液态氯化氢 | C. | 氯化钠溶液 | D. | 碳棒 |
13.公安部发布法令:从2011年5月1日起,醉酒驾驶机动车将一律入刑.下列关于酒精的叙述错误的是( )
| A. | 化学名称为乙醇 | B. | 易挥发 | ||
| C. | 常用作有机溶剂 | D. | 不能被酸性高锰酸钾氧化 |
20.分别进行下列溶液的导电性实验,灯泡最亮的是( )
| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
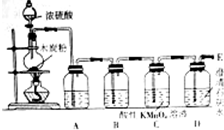 在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题:
在100mL 18.4mol•L-1浓硫酸中加入1.2g木炭粉,加热使之充分反应.并按如图的装置图进行实验,依次检验反应得到的产物,请回答下列问题: