题目内容
1.下列各组中的两种物质发生变化时,所克服的作用力属于同种类型的是( )| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 水和干冰的气化 | D. | 氯化钠和氯化氢溶于水 |
分析 原子晶体中需要克服共价键,分子晶体中需要克服分子间作用力,离子晶体中需要克服离子键,金属晶体需要克服金属键,根据晶体类型判断即可,据此分析解答.
解答 解:A.二氧化硅属于原子晶体,需要克服共价键,氯化镁属于离子晶体,需要克服离子键,所以克服作用力不同,故A不选;
B.碘属于分子晶体,需要克服分子间作用力,氯化铵属于离子晶体,需要克服离子键,所以克服作用力不同,故B不选;
C.水和干冰都属于分子晶体,需要克服分子间作用力,故C选;
D.氯化钠属于离子晶体,需要克服离子键,氯化氢属于分子晶体,需要克服共价键,所以克服作用力不同,故D不选;
故选C.
点评 本题考查了晶体的类型,明确晶体的构成微粒是解本题关键,难度不大.

练习册系列答案
相关题目
12.合成氨时采用700K左右的温度进行,主要是因为在该温度时( )
| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
9.二氧化硫、二氧化碳、三氧化硫同时具备的性质是( )
| A. | 都能使品红试液褪色 | |
| B. | 都能和氢氧化钠溶液反应生成盐和水 | |
| C. | 都有刺激性气味 | |
| D. | 常温下都是气体 |
10.下列表示对应化学反应的离子方程式正确的是( )
| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | 氯化铁溶液滴加到沸水中得到Fe(OH)3 胶体:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| C. | 铁溶于盐酸产生H2:2Fe+6H+═2Fe3++3H2↑ | |
| D. | Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O |
11.实验室常用NaNO2和NH4Cl加热反应制取N2,其余产物还有NaCl和水.下列有关说法正确的是( )
| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1 mol N2时转移6 mol电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
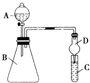 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验: ,违背了泡利不相容原理.
,违背了泡利不相容原理.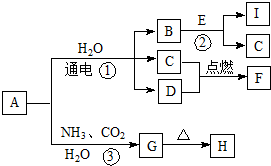 中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属.
中学化学中的一些常见物质有下图转化关系(部分产物未给出).其中A的焰色呈黄色,D常温下为黄绿色气体,反应③为侯氏制碱法反应原理之一,E是常见的金属. .
.