题目内容
6.现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大.请根据下列相关信息,回答问题:A元素原子的核外p电子总数比s电子总数少1
B元素原子p电子总数与s电子总数相等,且不与A元素在同一周期
C原子所有轨道全满或半满
D元素的主族序数与周期数的差为4
E是前四周期中电负性最小的元素
F在周期表的第七列
(1)A基态原子中能量最高的电子,其电子云在空间有3个方向,原子轨道呈纺锤形.
(2)某同学根据上述信息,所画的B原子的电子排布图为
 ,违背了泡利不相容原理.
,违背了泡利不相容原理.(3)F位于ⅦB族d区,其基态原子电子有25种运动状态,价电子排布式为3d54s2.
(4)CD3中心原子的杂化方式为sp3,用价层电子对互斥理论推测其分子空间构型为三角锥形.检验E元素的方法是焰色反应.
(5)HA3是一种弱酸,可部分电离出H+和A3-.配合物[Co(A3)(AH3)5]SO4中的配体是N3-、NH3(填化学式),钴离子的配位数是6.
分析 A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,故A为N元素;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C处于第三周期,C原子核外所有p轨道全满或半满,最外层排布为3s23p3,故C为P元素;D处于第三周期,D元素的主族序数与周期数的差为4,处于ⅦA族,故D为Cl元素;E是前四周期中电负性最小的元素,则E为K元素;F在周期表的第四周期第7列,则F为Mn,据此解答.
解答 解:A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大,A元素原子的核外p电子数比s电子数少1,电子排布为1s22s22p3,故A为N元素;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期,则其电子排布为1s22s22p63s2,故B为Mg;C处于第三周期,C原子核外所有p轨道全满或半满,最外层排布为3s23p3,故C为P元素;D处于第三周期,D元素的主族序数与周期数的差为4,处于ⅦA族,故D为Cl元素;E是前四周期中电负性最小的元素,则E为K元素;F在周期表的第四周期第7列,则F为Mn.
(1)A为N元素,核外电子排布式为1s2ns2np3,基态原子中能量最高的电子,处于2p能级,有3个电子,其电子云在空间有3个方向,原子轨道呈纺锤形,
故答案为:3;纺锤;
(2)某同学根据上述信息,推断B基态原子的核外电子排布为 ,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,
,该同学所画的电子排布图中3s能级,2个电子自旋方向相同,违背了泡利不相容原理,
故答案为:泡利不相容;
(3)F为Mn元素,处于周期表中第四周期ⅦB族,属于d区元素,核外有25个电子,运动状态均不相同,有25种不同运动状态,价电子排布式为:3d54s2,
故答案为:ⅦB;d;25;3d54s2;
(4)PCl3中心原子P原子成3个σ键,P原子价层电子对是为3+1=4,含有1对孤对电子对,杂化轨道数为4,杂化方式为sp3,其空间构型为三角锥;
E为K元素,检验K元素的方法是:焰色反应,
故答案为:sp3;三角锥形;焰色反应.
(5)HN3是一种弱酸,可部分电离出H+和N3-.配体含有孤对电子,配合物[Co(N3)(NH3)5]SO4中的配体是:N3-、NH3,钴离子的配位数是6,
故答案为:N3-、NH3;6.
点评 本题是对物质结构与性质的考查,涉及核外电子运动与排布规律、杂化轨道理论、分子结构等,难度中等,推断元素是解题的关键,注意对基础知识的掌握.

 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 氯气可用于自来水消毒 | B. | 甲醛可用作食品防腐剂 | ||
| C. | 碳酸钠可用来治疗胃酸过多 | D. | 铝制容器可长期存放碱性物质 |
| A. | NH5的电子式为: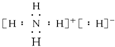 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: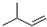 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
| A. | A、B、C三种元素形成的化合物中肯定只含共价键 | |
| B. | A、C形成的化合物中只有A-C键 | |
| C. | 工业上生产单质D可用海水作原料获得 | |
| D. | 化合物DC与化合物EC2中化学键类型相同 |
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 水和干冰的气化 | D. | 氯化钠和氯化氢溶于水 |
| A. | 二者燃烧时现象完全相同 | |
| B. | 点燃前都不需要验纯 | |
| C. | 甲烷燃烧火焰呈淡蓝色,乙烯燃烧火焰较明亮 | |
| D. | 二者燃烧时都有黑烟生成 |
| A. | 加入稀盐酸 | B. | 加入NaOH溶液 | C. | 加入澄清石灰水 | D. | 通入CO2 |
(1)陶瓷、水泥和玻璃都属于传统硅酸盐材料.其中,生产普通玻璃的主要原料除了SiO2、Na2CO3外还CaCO3.玻璃制作过程中发生了Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2的反应,碳酸酸性强于硅酸,但为什么该反应可在高温下发生?高温下Na2SiO3的稳定性比Na2CO3强.
(2)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

①请写出反应Ⅱ、Ⅲ的化学方程式:ⅡSi+3HCl$\frac{\underline{\;\;△\;\;}}{\;}$SiHCl3+H2、ⅢSiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
②在流化床反应的产物中,SiHCl3大约占85%,所含有的其它物质的沸点数据如下表:
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/℃ | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
A.电炉加热 B.酒精灯加热 C.砂浴加热 D.水浴加热
③SiHCl3极易水解,其完全水解时的反应方程式为SiHCl3+4H2O=H4SiO4+H2↑+3HCl.
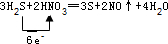 .
.