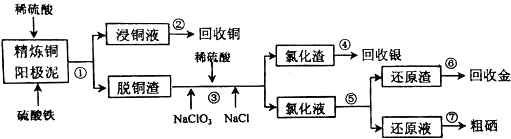
题目内容
12.合成氨时采用700K左右的温度进行,主要是因为在该温度时( )| A. | 合成氨的化学反应限度最大 | |
| B. | N2的转化率最高 | |
| C. | 催化剂的活性最大 | |
| D. | NH3在平衡混合气体中的体积分数最大 |
分析 N2+3H2$?_{高温高压}^{催化剂}$2NH3 △H<0,该反应是气体体积减小、放热的可逆反应,要使平衡向正反应方向移动,应降低温度、增大压强,但温度过低反应速率过小,不利于工业生成效益;温度越高,反应速率越大,所以应适当升高温度,使反应速率增大;使用催化剂也能增大反应速率,但在500℃左右时催化剂的活性最大,所以选择采用500℃左右的温度进行来分析.
解答 解:A.该反应为放热反应,温度越高,平衡向着逆向移动,不利于氨的合成,故A错误;
B.温度越低压强越大,氮气的转化率越大,700℃左右不是最低温度,故B错误;
C.该温度时,催化剂的活性最大,有利于氨的合成,故C正确;
D.压强越大,温度越低,生成氨气的量越大,氨气在平衡混合气体中的体积分数最大,500℃左右不是最低温度,故D错误;
故选C.
点评 本题以合成氨为载体考查了化学平衡移动原理,题目难度中等,明确化学平衡及其影响为解答关键,注意掌握合成氨原理,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
3.1mol某气态烃能与1mol氯化氢发生加成反应,加成后的产物又可与7mol氯气发生完全的取代反应,则该烃的结构简式为( )
| A. | CH2═CH2 | B. | CH3CH═CH2 | C. | CH3CH2CH═CH2 | D. | CH3CH2CH2CH═CH2 |
20.已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示.下列说法正确的是( )
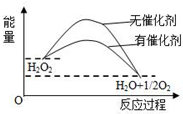

| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 加入催化剂,可提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2=H2O+$\frac{1}{2}$O2+Q | |
| D. | 反应物的总能量高于生成物的总能量 |
17.下列表述中正确的是( )
| A. | NH5的电子式为: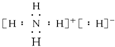 | |
| B. | 分馏、干馏、裂化都是化学变化 | |
| C. | 2-甲基-1-丁烯的结构简式: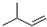 | |
| D. | NaHSO4和Na2O2的阴、阳离子个数比均为1:2 |
1.下列各组中的两种物质发生变化时,所克服的作用力属于同种类型的是( )
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 水和干冰的气化 | D. | 氯化钠和氯化氢溶于水 |

 如图,请读题并填空:在图中,
如图,请读题并填空:在图中, 将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.
将一定质量的镁铝合金投入200mL 一定浓度的盐酸中,合金完全溶解.