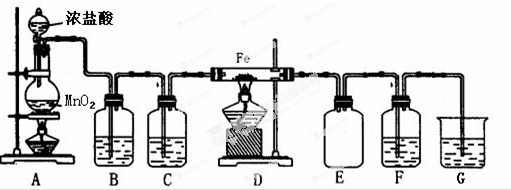
题目内容
11.实验室常用NaNO2和NH4Cl加热反应制取N2,其余产物还有NaCl和水.下列有关说法正确的是( )| A. | NaNO2是还原剂 | |
| B. | NH4Cl中N元素被还原 | |
| C. | 生成1 mol N2时转移6 mol电子 | |
| D. | 氧化剂和还原剂的物质的量之比是1:1 |
分析 用NH4Cl和NaNO2反应制取N2,NaNO2中N元素的化合价由+3价降低为0,NH4Cl中N元素的化合价由-3价升高为0,依据原子个数守恒、得失电子守恒反应方程式为:NaNO2+NH4Cl=NaCl+N2↑+2H2O,据此解答.
解答 解:A.用NH4Cl和NaNO2反应制取N2,NaNO2中N元素的化合价由+3价降低为0,NaNO2是氧化剂,故A错误;
B.用NH4Cl和NaNO2反应制取N2,反应中NH4Cl中的-3价N化合价升高,被氧化,故B错误;
C.依据方程式:NaNO2+NH4Cl=NaCl+N2↑+2H2O,每生成1mol N2时,由化合价的变化可知,转移电子的物质的量为3mol,故C错误;
D.NaNO2中N元素的化合价由+3价降低为0,为氧化剂,NH4Cl中N元素的化合价由-3价升高为0,为还原剂,则氧化剂和还原剂的物质的量之比是1:1,故D正确;
故选:D.
点评 本题考查氧化还原反应和电子式,把握氧化还原反应元素的化合价变化为解答的关键,注意转移电子数目的计算,题目难度中等.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案
相关题目
1.下列各组中的两种物质发生变化时,所克服的作用力属于同种类型的是( )
| A. | 二氧化硅和氯化镁熔化 | B. | 碘和氯化铵受热变成气体 | ||
| C. | 水和干冰的气化 | D. | 氯化钠和氯化氢溶于水 |
19.下列离子方程式正确的是( )
| A. | 混合小苏打和烧碱溶液 HCO3-+H+═H2O+CO2↑ | |
| B. | 氯化铝溶液中加入氨水Al3++3OH-═Al(OH)3↓ | |
| C. | 加热碳酸氢钙溶液 Ca2++2HCO3-═CaCO3↓+H2O+CO2↑ | |
| D. | 氢氧化镁中加入稀硫酸H++OH-═H2O |
6.空气污染指数(API)与空气质量等级关系可以用下图表示.

下表是某城市某日空气质量报告
(1)表中的PM10指的是可吸入颗粒物
(2)某日该城市市区各项污染物污染指数分别为:SO2-58,NO2-21,PM10-23,则当日首要污染物为二氧化硫(SO2),空气质量级别为良(选填“轻微污染”、“良”、“优”)
(3)空气中硫的氧化物和氮的氧化物随雨水降下,反应生成酸,当雨水的pH<(选填“>”、“<”、“=”)5.6时,称之为酸雨.现有一份雨水样品,每隔一段时间测定该样品的pH,发现随着时间的推移,pH将变小(选填“变大”、“变小”、“不变”).
(4)我国是燃煤大国,现测得某燃煤样品中含硫质量分数为0.032%,燃烧1吨该燃煤,理论上可生成SO222.4L(标准状况)(S+O2═SO2,S的摩尔质量为32g/mol).请你提出一种治理酸雨的措施使用清洁能源、燃煤脱硫等.

下表是某城市某日空气质量报告
| 污 染 指 数 | 首要 污染物 | 空气 质量等级 | ||
| SO2 | NO2 | PM10 | ||
| 23 | 35 | 56 | PM10 | 良 |
(2)某日该城市市区各项污染物污染指数分别为:SO2-58,NO2-21,PM10-23,则当日首要污染物为二氧化硫(SO2),空气质量级别为良(选填“轻微污染”、“良”、“优”)
(3)空气中硫的氧化物和氮的氧化物随雨水降下,反应生成酸,当雨水的pH<(选填“>”、“<”、“=”)5.6时,称之为酸雨.现有一份雨水样品,每隔一段时间测定该样品的pH,发现随着时间的推移,pH将变小(选填“变大”、“变小”、“不变”).
(4)我国是燃煤大国,现测得某燃煤样品中含硫质量分数为0.032%,燃烧1吨该燃煤,理论上可生成SO222.4L(标准状况)(S+O2═SO2,S的摩尔质量为32g/mol).请你提出一种治理酸雨的措施使用清洁能源、燃煤脱硫等.
3.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 标准状况下,11.2L CCl4所含原子数目为2.5NA | |
| B. | 常温常压下,64g SO2中含有的原子数为3NA | |
| C. | 将1 mol Cl2通入水中能生成1mol HClO | |
| D. | 2L 0.1 mol•L-1K2SO4溶液中含K+物质的量为0.2 mol |
5.下列离子在溶液中可以大量共存的一组是( )
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
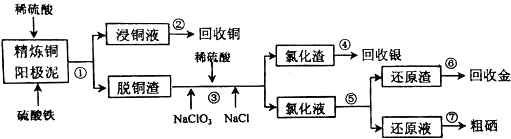
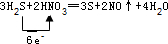 .
.