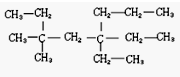
题目内容
8.镁燃料电池具有比能量(指参与电极反应的单位质量的电极材料放出电能的大小)高、燃料易于贮运等优点,拥有良好的应用前景,下图为“镁-次氯酸盐”燃料电池原理示意图,总反应为Mg+ClO-+H2O═Mg(OH)2+Cl-,镁合金电极可以是Mg与Al或Li的合金.下列说法不正确的( )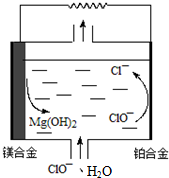
| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |
分析 A.单位质量的Li比Al转移的电子多;
B.ClO-在正极上得电子生成Cl-,阴离子向负极移动;
C.Mg的活泼性较强能与水反应生成氢气;
D.H2O2在正极上得电子生成H2O.
解答 解:A.7gLi转移1mol电子,27gAl转移3mol电子,所以单位质量的Li比Al转移的电子多,因此Mg-Li合金比传统的Mg-Al合金具有更高的比能量,故A正确;
B.镁合金作负极,铂合金作正极,ClO-在正极上得电子生成Cl-,电极方程式为:ClO-+H2O═Cl-+2OH--2e-,阴离子向负极移动,即OH-向镁合金电极迁移,故B正确;
C.Mg的活泼性较强能与水反应生成氢气,其反应为:Mg+2H2O═Mg(OH)2+H2↑,发生自腐蚀产生氢气,使负极利用率降低,故C正确;
D.把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,镁合金作负极,H2O2在正极上得电子生成H2O,故D错误.
故选D.
点评 本题考查了原电池原理,题目难度中等,明确正负极上发生的反应是解本题关键,再结合离子移动方向来分析解答,试题培养了学生的分析、理解能力及灵活应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.用下列装置进行实验,装置正确且能达到相应实验目的是( )
| A. | 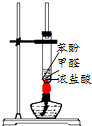 用图所示装置制备酚醛树脂 | B. | 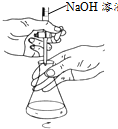 用图所示装置测定盐酸浓度 | ||
| C. | 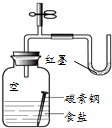 用图所示装置观察吸氧腐蚀 | D. | 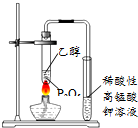 用图所示装置验证产生乙烯 |
16.下列化学用语表达正确的是( )
| A. | 二氧化碳的电子式: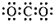 | B. | 铝离子的结构示意图: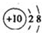 | ||
| C. | 次氯酸的结构式:H-O-Cl | D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
13.下列关于热化学反应反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H20(l)△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-2×(-57.3)kJ•mol-1 | |
| B. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2kJ/mol可知,红磷比白磷稳定 | |
| C. | H2(g)的燃烧热是285.8kJ•mol-1,则2H2O═2H2(g)+O2(g)△H=+571.6KJ•mol-1 | |
| D. | 恒温恒容时,将2molA和1molB投入密闭容器中,发生反应:2A(g)+B(g)?2C(g).充分反应后测得放出的热量为QkJ,则该反应的△H=-QkJ/mol |
17.类比(比较)是研究物质性质的常用方法之一,可预测许多物质的性质.但类比是相对的,不能违背客观实际.下列说法中正确的是( )
| A. | CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4A1(OH)3+3CH4↑ | |
| B. | O2与Cu加热生成CuO,则S与Cu加热生成CuS | |
| C. | 根据化合价Fe3O4可表示为FeO•Fe2O3,则Pb3O4也可表示为PbO•Pb2O3 | |
| D. | SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀 |
18.某有机化合物的结构简式为: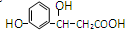 ,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
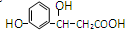 ,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )
,它可以发生反应的类型有①加成 ②消去 ③水解 ④酯化 ⑤氧化 ⑥加聚,其中组合完全且正确的是( )| A. | ①②③④ | B. | ①②④⑤ | C. | ①②⑤⑥ | D. | ①②③④⑤ |