题目内容
20.化学与生产、生活息息相关.现有下列5种有机物:①乙炔 ②甲苯 ③氟氯代烷 ④甘油⑤甲醛,请将相应的序号填入空格内.
(1)属于芳香烃,可用于合成炸药的是②;
(2)曾被广泛用作制冷剂,但对环境有严重危害的是③;
(3)通常用于配制化妆品的是④;
(4)常用于焊接或切割金属的是①;
(5)易溶于水,其水溶液常用于保存标本⑤.
分析 (1)属于芳香烃,一个含有苯环;
(2)氟氯代烷曾被广泛用作制冷剂;
(3)甘油具有吸水性,通常用于配制化妆品;
(4)乙炔燃烧放出大量的热,火焰温度较高;
(5)易溶于水,其水溶液常用于保存标本,一般应可使蛋白质变性.
解答 解:(1)属于芳香烃,一个含有苯环,只有甲苯符合,可与浓硝酸发生硝化反应制备三硝基甲苯,用作炸药,故答案为:②;
(2)氟氯代烷曾被广泛用作制冷剂,可导致臭氧空洞,污染环境,故答案为:③;
(3)甘油具有吸水性,通常用于配制化妆品,故答案为:④;
(4)乙炔燃烧放出大量的热,火焰温度较高,可用于焊接或切割金属,故答案为:①;
(5)甲醛易溶于水,其水溶液常用于保存标本,故答案为:⑤.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重常见有机物性质及用途的考查,注意有机物在生活、生产等方面的重要应用,题目难度不大.

练习册系列答案
 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案
相关题目
8.镁燃料电池具有比能量(指参与电极反应的单位质量的电极材料放出电能的大小)高、燃料易于贮运等优点,拥有良好的应用前景,下图为“镁-次氯酸盐”燃料电池原理示意图,总反应为Mg+ClO-+H2O═Mg(OH)2+Cl-,镁合金电极可以是Mg与Al或Li的合金.下列说法不正确的( )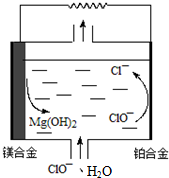

| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |
15.对于平衡体系2SO2(g)+O2(g)?2SO3(g)△H<0.下列结论中正确的是( )
| A. | 若温度不变,将容器的体积增大一倍,此时的SO2浓度变为原来的0.5倍 | |
| B. | 若平衡时SO2、O2的转化率相等,说明反应开始时,两者的物质的量这比为2:1 | |
| C. | 若从平衡体系中分离出SO3,则有利于提高SO2的转化率和加快正反应速率 | |
| D. | 平衡状态时SO2、O2、SO3的物质的量之比一定为2:1:2 |
5.氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得.
(1)氨气的发生装置可以选择如图1中的A或B,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→d→c→f→e→i(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是氨水不稳定受热易分解生成氨气和水,导致溶液碱性减弱,则溶液颜色变浅.
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度增大(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案不合理(填“合理”或“不合理”),请分析:根据上述实验,加热煮沸无法除去溶液A中混有的过量氯化氢.改进方案:向含碳酸钠的氯化钠溶液中边逐滴加盐酸,边测定溶液的pH,至溶液呈中性即可(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.

(1)氨气的发生装置可以选择如图1中的A或B,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→d→c→f→e→i(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
| 实验操作 | 实验现象及结论 |
| 将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
| 将浸有酚酞溶液的滤纸湿润后,放入盛有干操氨气的集气瓶中 | 滤纸变红,说明氨气遇水形成溶液呈碱性 |
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度增大(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案不合理(填“合理”或“不合理”),请分析:根据上述实验,加热煮沸无法除去溶液A中混有的过量氯化氢.改进方案:向含碳酸钠的氯化钠溶液中边逐滴加盐酸,边测定溶液的pH,至溶液呈中性即可(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅,最后褪为无色 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中的NaOH溶液倒吸入Y管中 | ④该反应是气体体积减小的反应,Y管内压强降低,在大气压的作用下发生倒吸 |
12.化学与生活、社会密切相关,下列说法正确的是( )
| A. | 生铁在潮湿的空气中易发生化学腐蚀而锈蚀 | |
| B. | 海水淡化能解决淡水供应危机,向海水中加净水剂明矾可以使海水淡化 | |
| C. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| D. | 在米汤中加入食盐,可以检验食盐中是否加碘 |
9.类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中,你认为正确的是( )
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | 因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4 |
10.设NA为阿伏加罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 3mol铁与足量的水蒸气充分反应,转移8NA个电子 | |
| C. | 50mL18.4mol•L-1浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
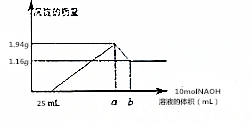 将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:
将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题: