题目内容
15.用下列装置进行实验,装置正确且能达到相应实验目的是( )| A. | 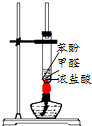 用图所示装置制备酚醛树脂 | B. | 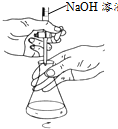 用图所示装置测定盐酸浓度 | ||
| C. | 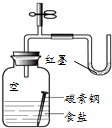 用图所示装置观察吸氧腐蚀 | D. | 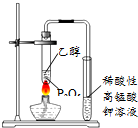 用图所示装置验证产生乙烯 |
分析 A.苯酚和甲醛在水浴加热下可生成酚醛树脂;
B.图中为酸式滴定管,不能盛放NaOH溶液;
C.食盐水为中性,Fe发生吸氧腐蚀,瓶内空气减少;
D.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化.
解答 解:A.苯酚和甲醛在水浴加热下可生成酚醛树脂,则图中加热方法不合理,故A错误;
B.图中为酸式滴定管,不能盛放NaOH溶液,应选碱式滴定管,故B错误;
C.食盐水为中性,Fe发生吸氧腐蚀,瓶内空气减少,U型管中红墨水左高右低,装置可观察吸氧腐蚀,故C正确;
D.乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化,则不能验证产生乙烯,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高考常见题型,涉及中和滴定、电化学腐蚀、有机物制备等基本实验,侧重于学生的分析能力、评价能力和实验能力的考查,注意把握实验的严密性和相关物质的性质,题目难度不大.

练习册系列答案
相关题目
5.下列表示物质结构的化学用语或模型正确的是( )
| A. | 甲酸甲酯的结构简式:C2H4O2 | B. | H2O2的电子式: | ||
| C. | 中子数为10 的氧原子:188O | D. | 对-硝基甲苯的结构简式: |
6.海边的铁制品比较容易生锈,月球上的铁不易腐蚀.钢铁发生腐蚀时,正极上发生的反应为( )
| A. | 2Fe-4e-═2Fe2+ | B. | 2Fe2++4e-═2Fe | ||
| C. | 2H2O+O2+4e-═4OH- | D. | 2Fe3++2e-═2Fe2+ |
3.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 25℃,pH=12的NaOH溶液中含有OH-的数目为0.01 NA | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| C. | 2.3g金属钠与过量氧气充分反应,无论加热与否转移电子数为0.1NA | |
| D. | 50mL 18.4mo1/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
10.下列离子方程式书写正确的是( )
| A. | Ca(HCO3)2 溶液中滴入过量NaOH溶液:HCO3-+Ca2++OH-═CaCO3↓+H2O | |
| B. | 向NaAlO2 溶液中通入过量的 CO2:CO2+2H2O+A1O2-═Al(OH)3↓+HCO3- | |
| C. | 0.01mol/L NH4Al(SO4)2 溶液与 0.02mol/L Ba(OH)2 溶液等体积混合:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 向Ca(ClO)2 溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
4.可逆反应2A(g)+2B(g)?3C(g)+D(g),下列能够判断已达到化学平衡状态的是( )
| A. | 单位时间内生成2n molB,同时消耗3n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
8.镁燃料电池具有比能量(指参与电极反应的单位质量的电极材料放出电能的大小)高、燃料易于贮运等优点,拥有良好的应用前景,下图为“镁-次氯酸盐”燃料电池原理示意图,总反应为Mg+ClO-+H2O═Mg(OH)2+Cl-,镁合金电极可以是Mg与Al或Li的合金.下列说法不正确的( )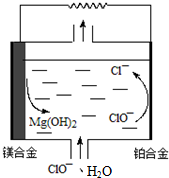

| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |
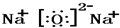 .
.