题目内容
13.(1)往某种BaCl2溶液中逐滴加入密度为1.28g/mL的硫酸溶液,恰好完全反应,过滤,滤液的质量恰好与原BaCl2溶液质量相等,此硫酸溶液的物质的量浓度为5.49mol/Lmol/L.(2)有一种硫化钠、亚硫酸钠和硫酸钠的混合物,经测定含硫25.6%,混合物中含氧37.6%.
(3)10.0g40%的氢氧化钠溶液与一定量盐酸恰好完全反应,形成该温度下的饱和溶液.加入盐酸的质量分数为30.2%.(该温度下氯化钠的溶解度为36g/100g水)
分析 (1)根据滤液的质量恰好与原氯化钡溶液的质量相等,则生成沉淀的质量和硫酸的质量相等.根据硫酸与氯化钡反应的化学方程式,由硫酸钡质量求出硫酸溶液中溶质的物质的量和质量,再由质量分数的定义和溶液中溶质的物质的量浓度定义计算;
(2)由Na2S、Na2SO3、Na2SO4组成的固体混合物中,三种钠盐中钠与硫元素的质量比均为46:32,则混合后钠与硫元素的质量比仍为46:32,根据硫元素质量分数计算Na元素质量分数,氧元素质量分数=1-w(Na)-w(S);
(3)设生成的氯化钠的质量是x
NaOH+HCl═NaCl+H2O
40 36.5 58.5
40%×10g 3.65g 5.85g,
所以所得饱和溶液的质量为:$\frac{5.85g}{\frac{36}{136}}$=22.1g,则盐酸的质量为:22.1g-10.0g=12.1g,加入盐酸的质量分数为$\frac{3.65g}{12.1g}×100%$=30.2%.
解答 解:(1)令硫酸钡的质量为233g,由于硫酸溶液的质量=硫酸钡的质量,则硫酸溶液的质量为233g,
所以硫酸溶液体积为$\frac{233g}{1.28g/mL}$=$\frac{233}{1.28}$mL
设硫酸溶液中溶质的物质的量为x,则
BaCl2+H2SO4═BaSO4↓+2HCl
1mol 233g
x 233g
x=1mol.
所以硫酸溶液中溶质的物质的量浓度为$\frac{1mol}{\frac{233}{1.28}L}$=5.49mol/L,
故答案为:5.49mol/L;
(2)三种钠盐中钠与硫元素的质量比均为46:32,则混合后钠与硫元素的质量比仍为46:32,S的质量分数为25.6%,则钠的质量分数为25.6%×$\frac{46}{32}$=36.8%,故氧元素的质量分数为1-25.6%-36.8%=37.6%,故答案为:37.6%;
(3)设生成的氯化钠的质量是x
NaOH+HCl═NaCl+H2O
40 36.5 58.5
40%×10g 3.65g 5.85g,
所以所得饱和溶液的质量为:$\frac{5.85g}{\frac{36}{136}}$=22.1g,则盐酸的质量为:22.1g-10.0g=12.1g,加入盐酸的质量分数为$\frac{3.65g}{12.1g}×100%$=30.2%,故答案为:30.2.
点评 本题考查质量分数有关计算和根据化学方程式的计算,根据是根据化学式确定Na、S元素质量之比为定值,较好考查学生分析计算能力,难度不大.

| A. | 25℃,pH=12的NaOH溶液中含有OH-的数目为0.01 NA | |
| B. | 已知N2(g)+3H2(g)?2NH3(g)△H=-92.4KJ/mol,在该反应中,当有3NA电子转移时,上述热化学反应方程式的焓变为△H=-46.2KJ/mol | |
| C. | 2.3g金属钠与过量氧气充分反应,无论加热与否转移电子数为0.1NA | |
| D. | 50mL 18.4mo1/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA |
| A. | 单位时间内生成2n molB,同时消耗3n molC | |
| B. | 容器内压强不随时间变化 | |
| C. | 混合气体的密度不随时间变化 | |
| D. | B物质的百分含量不变 |
| A. | 2:1 | B. | 1:2 | C. | 2:3 | D. | 3:2 |
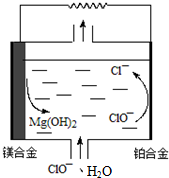
| A. | Mg-Li合金比传统的Mg-Al合金具有更高的比能量 | |
| B. | 铂合金的电极反应:ClO-+H2O═Cl-+2OH--2e-,OH-向镁合金电极迁移 | |
| C. | 该电池镁合金会发生自身腐蚀产生氢气,使电极利用率降低 | |
| D. | 把电解质换成H2O2、H2SO4和NaCl的混合溶液,工作时H2O2将参与电极反应,其电极反应为:2H2O2-2e-═O2↑+2H2O |

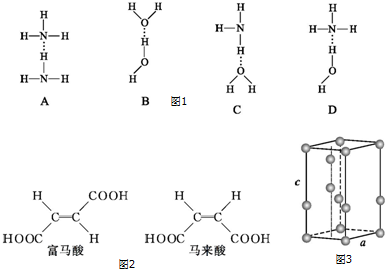
(1)氨气的发生装置可以选择如图1中的A或B,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→d→c→f→e→i(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
| 实验操作 | 实验现象及结论 |
| 将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
| 将浸有酚酞溶液的滤纸湿润后,放入盛有干操氨气的集气瓶中 | 滤纸变红,说明氨气遇水形成溶液呈碱性 |
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度增大(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案不合理(填“合理”或“不合理”),请分析:根据上述实验,加热煮沸无法除去溶液A中混有的过量氯化氢.改进方案:向含碳酸钠的氯化钠溶液中边逐滴加盐酸,边测定溶液的pH,至溶液呈中性即可(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅,最后褪为无色 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中的NaOH溶液倒吸入Y管中 | ④该反应是气体体积减小的反应,Y管内压强降低,在大气压的作用下发生倒吸 |
| A. | 反应不再进行 | B. | 反应物浓度等于生成物浓度 | ||
| C. | 正反应速率不等于逆反应速率 | D. | 各组分浓度不再随时间而变化 |
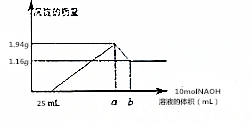 将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题:
将一定质量的镁和铝合金粉末溶解于50mL某浓度的盐酸中,等合金全部溶解后,再向其中加入某浓度的NaOH溶液,在此过程中,产生沉淀的质量与所需要消耗NaOH溶液的体积关系如图所示,试回答下列问题: