��Ŀ����
3�� ijѧУ����ѧϰ�С����Խ̲���ͭ��Ũ���ᷴӦ�������̽�����ܹ���ͭ��Ӧ����������Ũ���Ƕ��٣��������⣬����������·�������ʵ�飺
ijѧУ����ѧϰ�С����Խ̲���ͭ��Ũ���ᷴӦ�������̽�����ܹ���ͭ��Ӧ����������Ũ���Ƕ��٣��������⣬����������·�������ʵ�飺ʵ���Լ���18mol/L����20mL����ͭ������������2mol/LNaOH��Һ
�����ʵ��ش����⣺
��1�����ȸ�����ͼ��װʵ��װ�ã����ڼ����Լ�ǰ�Ƚ��м���װ�������Բ�����
��2���ձ�����NaOH��Һ���յ�������SO2���ѧʽ�������õ��õ�©�������ǽ�������ֱ�������ձ��е�Ŀ���Ƿ�������
��3��������ƿ20���ӣ���ƿ�з�����Ӧ�Ļ�ѧ����ʽ�ǣ�Cu+2H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O������ƿ�з�Ӧ������������ȥ�ƾ��ƣ���������ʹ��Ӧ������ȫ��Ȼ���ɵ���a ͨ�������Ŀ�������ȷ����ƿ�е�SO2����ȫ�������ձ��У��ڸ�ʵ��װ���еij����ܣ����������ƣ�����ȷ����ƿ��Һ������ڷ�Ӧǰ��������ֲ�������ã�
��4����ַ�Ӧ���ձ�ȡ�£��������ȼ���������ˮ���ټ���������BaCl2��Һ��Ȼ�����ν��й��ˡ�ϴ�ӡ��������������ƣ����������������Ϊ13.98g���ݴ˼��������ͭ��Ӧ����������Ũ����12mol/L��
���� ��1��װ�������巢��װ�ã���Ҫ�ڿ�ʼʱ���װ�õ������ԣ�
��2��������������Ⱦ�����岻���ŷŵ������У���Ҫ������������Һ���գ����õ��õ�©�������ǽ�������ֱ�������ձ����Ƿ�ֹҺ�嵹����
��3����ƿ����ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ��װ���г������ܼ��������������ã�ʹˮ��������������
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ���������������Ԫ�����ʵ�����������Ԫ���غ��ϻ�ѧ����ʽ������Ҫ��Ӧ���������Ũ�ȣ�
��� �⣺��1��ʵ��װ�����Ʊ�������������ķ���װ�ã���ʵ��ǰ��Ҫ����װ�������ԣ���ֹװ��©��Ӱ��ʵ�飬
�ʴ�Ϊ������װ�������ԣ�
��2��������������Ⱦ�����岻���ŷŵ������У���Ҫ������������Һ���գ����õ��õ�©�������ǽ�������ֱ�������ձ����Ƿ�ֹҺ�嵹����
�ʴ�Ϊ��SO2����������
��3����ƿ����ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��Cu+2H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O��װ���г������ܼ��������������ã�ʹˮ������������������ȷ��������Һ������ֲ�������ã�
�ʴ�Ϊ��Cu+2H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O�������ܣ�
��4��������������������������Ϊ�����ƣ������Ȼ�����Һ��Ӧ�������ᱵ������ͨ�����ˡ�ϴ�ӡ�����õ��������������������Ϊ13.98gΪ���ᱵ���������ʵ���=$\frac{13.98g}{233g/mol}$=0.06mol��������Ԫ���غ㣬������������Ϊ0.06mol�����ݻ�ѧ����ʽ��֪��Cu+2H2SO4$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O����Ӧ���������ʵ���Ϊ0.12mol��ʣ���������ʵ���=18mol/L��0.020L-0.12mol=0.24mol��ʣ����Ҫ�����Ũ��=$\frac{0.24mol}{0.02L}$=12mol/L��
�ʴ�Ϊ�����ˡ�ϴ�ӣ����12mol/L��
���� ���⿼����Ũ�������ʵķ���Ӧ�ã�ʵ����Ʒ�������Ʒ��������ջ����ǽ���ؼ�����Ŀ�Ѷ��еȣ�

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�| A�� | ��С���������ƽ�������ƶ� | |
| B�� | ���������ƽ�ⲻ�ƶ������淴Ӧ���ʲ��� | |
| C�� | ����c��X����X��ת�������� | |
| D�� | �����¶ȣ�Y��ת�������� |
| A�� | �����Ӿ��������� | B�� | �����ǻ�ԭ�� | ||
| C�� | ��������������Ӧ | D�� | �����ԣ�Cl2��Br2 |
| A�� | ���ܷ��������ЧӦ�ķ�ɢϵ����Һ | |
| B�� | ��1 L 2 mol/L��FeCl3��Һ�Ƴɽ�������к�����������������Ϊ2NA | |
| C�� | �������ӵĴ�С�뽺�������൱�����������ӵ���ϵ��һ���ǽ��� | |
| D�� | ������FeCl3��Һ���������ڣ��Ƶ�Fe��OH��3���� |
| A�� | a1��a2����С | B�� | a1��С��a2���� | C�� | a1�����䣬a2���� | D�� | a1���䣬a2��С |
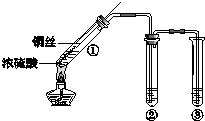 ijС��ͬѧ̽��Ũ���ἰ�䲿�ַ�Ӧ����Ļ�ѧ���ʣ�װ����ͼ��ʾ���г�װ����ȥ����
ijС��ͬѧ̽��Ũ���ἰ�䲿�ַ�Ӧ����Ļ�ѧ���ʣ�װ����ͼ��ʾ���г�װ����ȥ���� ij��ѧ��ȤС���ͬѧΪ̽����������Ļ�ѧ���ʣ��������ͼ��ʾ��װ�ã���ش��������⣮
ij��ѧ��ȤС���ͬѧΪ̽����������Ļ�ѧ���ʣ��������ͼ��ʾ��װ�ã���ش��������⣮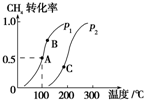 ������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����
������Ȼ�����Ƶ���H2��CO��Ϊ��Ҫ��ɵĹ�ҵԭ�Ϻϳ�������ӦΪ��CH4��g��+H2O��g��?CO��g��+3H2��g����