题目内容
5.从海水中可以提取溴,主要反应为:2Br-+Cl2=2Cl-+Br2,下列说法正确的是( )| A. | 溴离子具有氧化性 | B. | 氯气是还原剂 | ||
| C. | 氯气发生氧化反应 | D. | 氧化性:Cl2>Br2 |
分析 反应2Br-+Cl2=2Cl-+Br2中Cl元素化合价降低,Cl2为氧化剂,Br元素化合价升高,被氧化,Br-为还原剂,以此解答该题.
解答 解:A.溴离子化合价处于最低价态,只具有还原性,故A错误;
B.反应中Cl元素化合价降低,Cl2为氧化剂,故B错误;
C.Cl2为氧化剂,反应中有元素化合价的升降,为还原反应,故C错误;
D.根据氧化剂氧化性大于氧化产物氧化性可知,氧化性:Cl2>Br2,故D正确.
故选D.
点评 本题考查氧化还原反应,侧重于基本概念的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和性质,题目难度不大.

练习册系列答案
相关题目
15.已知反应:
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1;
②稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
下列结论正确的是( )
| A. | .碳的燃烧热△H=-110.5 kJ•mol-1 | |
| B. | .①的反应热为221 kJ•mol-1 | |
| C. | 浓硫酸与稀NaOH溶液反应生成1 mol水,放出的热量为57.3 kJ | |
| D. | .碳的燃烧热大于110.5 kJ•mol-1 |
16.已知2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,关于该反应的下列说法错误的是( )
| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 在该化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量 | |
| D. | 发生反应时,断开反应物中的H-H键和O-O键都要吸收能量 |
10.现要配置一定物质的量浓度的100mL1mol•L-1NaOH溶液,下列操作正确的是( )
| A. | 用蒸馏水洗涤烧杯、玻璃棒2~3次,每次洗涤后的溶液都注入容量瓶中 | |
| B. | 把称量的NaOH固体放入盛有适量蒸馏水的烧杯中,溶解后立即把溶液转移到容量瓶中 | |
| C. | 在托盘天平的两个托盘上各放一张大小一样的纸,然后将NaOH固体放在纸上进行称量 | |
| D. | 沿着玻璃棒往容量瓶中加入蒸馏水,直到溶液凹液面恰好与刻度相切 |
 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验: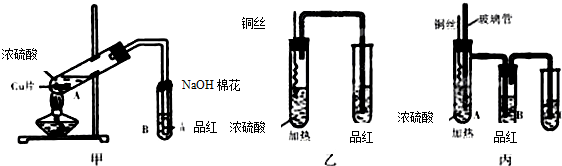
 某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.