题目内容
12. 利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).
利用天然气可制得以H2、CO等为主要组成的工业原料合成气,反应为:CH4(g)+H2O(g)?CO(g)+3H2(g).(1)甲烷与水蒸气反应,被氧化的元素是C
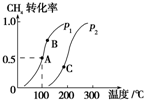
(2)将2mol CH4和5mol H2O(g)通入容积为100L的反应室,CH4的平衡转化率与温度、压强的关系如图.
①达到A点所需的时间为5min,则v(H2)=0.006mol•L-1•min-1
②图中的p1<p2(填“<”、“>”或“=”),A、B、C三点的平衡常数KA、KB、KC的大小关系是KC>KB>KA.
(3)合成气用于合成氨时需除去CO,发生反应CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,
下列措施中能使$\frac{n(C{O}_{2})}{n({H}_{2}O)}$增大的有AC(选填编号).
A.降低温度
B.恒温恒容下充入He(g)
C.将H2从体系中分离
D.再通入一定量的水蒸气
可用碳酸钾溶液吸收生成的CO2,常温下pH=10的碳酸钾溶液中由水电离出的c(OH-)为1×10-4mol•L-1,
常温下,0.1mol•L-1KHCO3溶液的pH>8,则溶液中c(H2CO3)>c(CO${\;}_{3}^{2-}$)(填“>”、“=”或“<”)
分析 (1)氧化还原反应中失电子化合价升高的元素被氧化;
(2)①A点时甲烷的转化率为0.5,则参加反应的n(CH4)=2mol×0.5=1mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,所以生成氢气n(H2)=3n(CH4)=1mol×3=3mol,则氢气平均反应速率=$\frac{\frac{△n}{V}}{△t}$;
②该反应前后气体物质的量增大,增大压强平衡逆向移动,则甲烷转化率降低,根据相同温度下甲烷转化率判断压强相对大小;
根据图知,一定压强下,升高温度,甲烷转化率增大,平衡正向移动,则正反应是吸热反应;
(3)该反应的正反应是放热反应,要使$\frac{n(C{O}_{2})}{n({H}_{2}O)}$增大,可以使二氧化碳物质的量增大或水蒸气物质的量减小来实现;
碳酸根离子水解导致碳酸钾溶液呈碱性,常温下pH=10的碳酸钾溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$;常温下,0.1mol•L-1KHCO3溶液的pH>8,溶液呈碱性,说明HCO3-水解程度大于电离程度.
解答 解:(1)氧化还原反应中失电子化合价升高的元素被氧化,该反应中C元素化合价由-4价变为+2价、H元素化合价由+1价变为0价,所以C元素被氧化,故答案为:C;
(2)①A点时甲烷的转化率为0.5,则参加反应的n(CH4)=2mol×0.5=1mol,同一可逆反应中同一段时间内参加反应的各物质的物质的量之比等于其计量数之比,所以生成氢气n(H2)=3n(CH4)=1mol×3=3mol,则氢气平均反应速率=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{3mol}{100L}}{5min}$=0.006 mol•L-1•min-1,故答案为:0.006 mol•L-1•min-1;
②该反应前后气体物质的量增大,增大压强平衡逆向移动,则甲烷转化率降低,根据图知,相同温度下从P1到P2,甲烷转化率降低,说明平衡逆向移动,应该是增大压强,所以p1<p2;
根据图知,一定压强下,升高温度,甲烷转化率增大,平衡正向移动,则正反应是吸热反应,根据图知,温度越高甲烷的转化率越大,则化学平衡常数越大,所以KC>KB>KA,
故答案为:<;KC>KB>KA;
(3)A.降低温度,平衡正向移动,所以$\frac{n(C{O}_{2})}{n({H}_{2}O)}$增大,故A正确;
B.恒温恒容下充入He(g),各物质浓度不变,化学平衡不移动,则$\frac{n(C{O}_{2})}{n({H}_{2}O)}$不变,故B错误;
C.将H2从体系中分离,平衡正向移动,则$\frac{n(C{O}_{2})}{n({H}_{2}O)}$增大,故C正确;
D.再通入一定量的水蒸气,平衡正向移动,但加入的水蒸气远远大于水蒸气参加反应的增加量,所以
$\frac{n(C{O}_{2})}{n({H}_{2}O)}$减小,故D错误;
故选AC;
碳酸根离子水解导致碳酸钾溶液呈碱性,常温下pH=10的碳酸钾溶液中由水电离出的c(OH-)=$\frac{{K}_{w}}{1{0}^{-pH}}$=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=1×10-4 mol•L-1;常温下,0.1mol•L-1KHCO3溶液的pH>8,溶液呈碱性,说明HCO3-水解程度大于电离程度,则则溶液中c(H2CO3)>c(CO${\;}_{3}^{2-}$),故答案为:AC;1×10-4 mol•L-1;>.
点评 本题考查化学平衡计算、化学平衡影响因素等知识点,侧重考查学生理解分析计算能力,明确图象含义、外界条件对化学平衡移动影响原理及盐类水解原理是解本题关键,注意(3)D选项为易错点,很多同学往往平衡正向移动会导致$\frac{n(C{O}_{2})}{n({H}_{2}O)}$增大,题目难度中等.

| A. | 该反应是一个放热反应 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成的水的总能量 | |
| C. | 在该化学反应中,破坏旧化学键吸收的能量大于形成新化学键释放的能量 | |
| D. | 发生反应时,断开反应物中的H-H键和O-O键都要吸收能量 |
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
| 化学方程式 | K(t1) | K(t2) | |
| ① | Br2 (g)+H2(g)?2HBr(g) | 5.6×107 | 9.3×106 |
| ② | I2 (g)+H2 (g)?2HI(g) | 43 | 34 |
| A. | ①和②均是放热反应 | |
| B. | 相同条件下,平衡体系中HX所占的比例:①>② | |
| C. | 其他条件不变时,增大压强可提高X2的平衡转化率 | |
| D. | 其他条件不变时,升高温度可加快HX的生成速率 |
 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验: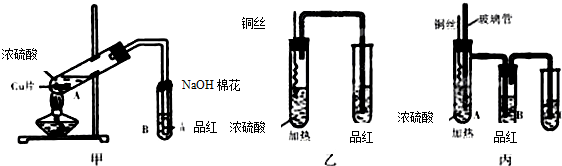
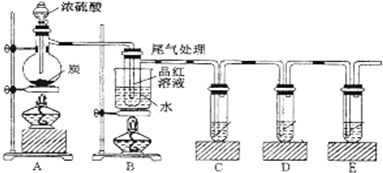
 某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.