题目内容
12.下列说法正确的是( )| A. | 不能发生丁达尔效应的分散系是溶液 | |
| B. | 将1 L 2 mol/L的FeCl3溶液制成胶体后,其中含有氢氧化铁胶粒数为2NA | |
| C. | 纳米粒子的大小与胶体粒子相当,但纳米粒子的体系不一定是胶体 | |
| D. | 将饱和FeCl3溶液加热至沸腾,制得Fe(OH)3胶体 |
分析 A.溶液和浊液都不能发生丁达尔效应;
B.一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
C.胶体粒子直径大小在1~100nm之间;
D.依据制备氢氧化铁胶体方法解答.
解答 解:A.不能发生丁达尔效应的分散系是溶液或者胶体,故A错误;
B.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故形成的胶粒的个数小于2NA个,故C错误;
C.胶体粒子直径大小在1~100nm之间,与纳米级粒子的尺寸相当,纳米级粒子分散在分散剂中才形成胶体,故C正确;
D.制备氢氧化铁胶体应将饱和FeCl3溶液加至沸腾的蒸馏水,故D错误;
故选:C.
点评 本题考查了胶体的性质,明确胶体的本质特征为分散质粒度大小,熟悉胶体据此、电泳的性质,熟悉氢氧化铁胶体制备原理是解题关键,题目难度不大.

练习册系列答案
相关题目
3.有下列8种物质:①甲烷;②苯;③聚乙烯;④聚异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
7.下列说法正确的是( )
| A. | NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42- NaHCO3在水中的电离方程式为:NaHCO3=Na++H++CO32- | |
| B. | NaCl溶液能导电是因为溶液中有能自由移动的Na+和Cl- | |
| C. | 液态氯化氢和稀盐酸一样可以导电 | |
| D. | 向某溶液中加入BaCl2溶液,产生白色沉淀,再加入盐酸,沉淀不消失,则原溶液中一定含有SO42- |
8.在密闭容器中反应aR(g)+bQ(g)?cX(g)+dY(g)达平衡后,保持温度不变,将容器体积增加一倍,达到新平衡时,X浓度是原来的60%,则下列说法正确的是( )
| A. | 平衡向正反应方向移动了 | B. | 物质R的转化率减少了 | ||
| C. | 物质X的质量分数减少了 | D. | a+b<c+d |
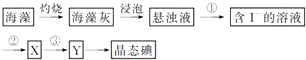

 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验: