题目内容
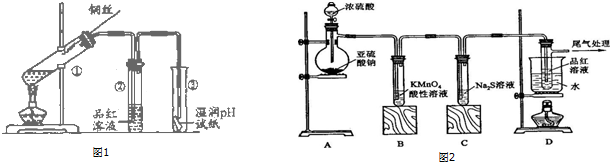
15. 某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.
某化学兴趣小组的同学为探究二氧化硫的化学性质,设计了如图所示的装置.请回答下列问题.(1)某同学拧开分液漏斗下面的活塞后发现开始时能流出,但一会就停止了,情分析原因:随着反应的进行,圆底烧瓶内压强增大,导致液体不能顺利滴下.
(2)铜和浓硫酸反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(3)B瓶中盛有品红溶液,观察到品红溶液褪色,这是因为 SO2具有C(填选项的字母,下同),C瓶中盛有新制的氯水,观察到氯水褪色,这是因为SO2具有B.
A.氧化性 B.还原性 C.漂白性
(4)D瓶中盛有NaOH溶液,作用是吸收尾气,防止污染.
分析 (1)铜与浓硫酸加热反应生成二氧化硫气体,烧瓶中压强增大,导致气体不能顺利留下;
(2)铜和热的浓硫酸反应生成二氧化硫、硫酸铜和水;
(3)二氧化硫与品红作用,二氧化硫具有漂白性;二氧化硫与氯水作用,二氧化硫具有还原性;
(4)铜和热的浓硫酸反应,生成的二氧化硫为大气污染物,氢氧化钠和二氧化硫反应生成亚硫酸钠和水.
解答 解:(1)由于铜与浓硫酸加热生成二氧化硫气体,随着反应的进行,圆底烧瓶内压强增大,导致液体不能顺利滴下,所以反应停止了,
故答案为:随着反应的进行,圆底烧瓶内压强增大,导致液体不能顺利滴下;
(2)铜和热的浓硫酸反应铜作还原剂,硫酸作氧化剂,生成二氧化硫、硫酸铜和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)二氧化硫与品红溶液反应生成不稳定的无色物质,二氧化硫与品红作用,二氧化硫具有漂白性;二氧化硫具有还原性,能被氯水氧化,氯水褪色,发生O2+C12+2H2O=H2SO4+2HC1,
故答案为:C;B;
(4)SO2是酸性氧化物,也是大气污染物,所以用NaOH溶液吸收,氢氧化钠和二氧化硫反应生成亚硫酸钠和水,反应的方程式为:2NaOH+SO2=Na2SO3+H2O,
故答案为:吸收尾气,防止污染.
点评 本题考查了浓硫酸的性质,题目难度不大,明确发生反应的实质为解答关键,注意掌握二氧化硫的性质及检验方法,试题侧重考查学生的分析、理解能力你化学实验能力.

练习册系列答案
相关题目
19.下列有关阿伏加德罗常数(NA)的说法错误的是( )
| A. | 32克O2所含的原子数目为2NA | |
| B. | 0.5molH2O含有的原子数目为1.5NA | |
| C. | 1molH2O含有的H2O分子数目为NA | |
| D. | 0.5NA个氯气分子的物质的量是1mol |
4.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液时,下列操作中不正确的是( )
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
5.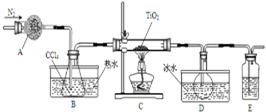 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
(1)仪器A的名称是干燥管,装置E中的试剂是浓硫酸.反应开始前依次进行如下操作:组装仪器、检验气密性、加装药品、通N2一段时间后点燃酒精灯.
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
 实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.
实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下,有关物质性质如表.| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产白雾 |
(2)反应结束后的操作包括:a停止通N2 b熄灭酒精灯 c冷却至室温.正确的顺序为bca(填序号).选择这种顺序的理由是防止倒吸或避免生成的产物在受热情况下与氧气反应(二者任写其一均给分);欲分离D中的液态混合物,所采用操作的名称是蒸馏.
 某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验:
某学校课外学习活动小组针对教材中铜与浓硫酸反应,提出了探究“能够与铜反应的硫酸的最低浓度是多少?”的问题,并设计了如下方案进行实验: