题目内容
8.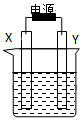 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
分析 电解时X电极表面有红色固体生成,应析出铜,则X为阴极,发生Cu2++2e-═Cu,Y为阳极,阳极生成氯气,发生2Cl--2e-═Cl2↑,一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g,可知n(Cu)=$\frac{1.6}{64g/mol}$=0.025mol,结合电极方程式解答该题.
解答 解:A.X为阴极,连接电源的负极,故A错误;
B.气体存在的条件未知,不能确定体积,故B错误;
C.Y为阳极,发生氧化反应生成氯气,故C正确;
D.电极增重1.6g,不一定所有的铜都析出,则不能确定氯化铜的浓度,故D错误.
故选C.
点评 本题考查电解知识,为高频考点,侧重考查学生的分析、计算能力,注意把握电解的原理,能会书写电极方程式,易错点为B、D,注意气体存在的条件以及电解的程度,难度不大.

练习册系列答案
相关题目
1.下列装置能达到相应实验目的是( )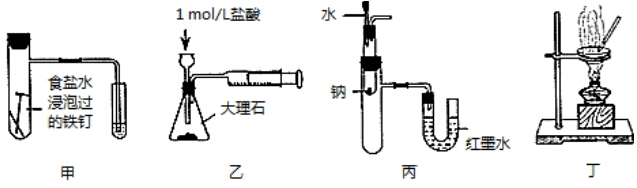

| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
17.短周期主族元素D、E、G、J的原子序数依次增大.D和J位于同主族,D和E的原子序数相差1,G的最高价氧化物对应的水化物既能与盐酸反应,又能与烧碱反应,J原子的电子总数等于最外层电子数的3倍.下列推断正确的是( )
| A. | 气态氢化物的热稳定性:E>d>J | |
| B. | 原子半径:G>E>J>D | |
| C. | 最高价氧化物对应水化物的酸性:J>D>G | |
| D. | E和J组成的化合物常作食品的干燥剂 |
4.设NA为阿伏伽德罗常数.下列叙述中正确的是( )
| A. | 0.25mol Na2O2中含有的阴离子数为0.5NA | |
| B. | 等物质的量的OH-与烃基(-OH)所含电子数相等 | |
| C. | 惰性电极电解食盐水,若电路中通过NA个电子,则标况下阳极产生气体11.2L | |
| D. | 25℃时,pH=13的1.0LBa(OH)2溶液中含OH-数目为0.2NA |
13.下列实验操作、现象和结论都正确的是( )
| 选项 | 实验 | 现象 | 结论 |
| A | 在Fe(NO3)2溶液中滴加酸化的H2O2 | 浅绿色变黄色 | H2O2具有氧化性 |
| B | 在酸性KMnO4溶液中滴加植物油 | 紫色变浅 | 植物油含有酯基 |
| C | 将稀硫酸滴入Na2CO3溶液中产生的气体通入Na2SiO3溶液中 | 有白色沉淀生成 | 证明非金属性C>S>Si |
| D | 向淀粉水解液中加入适量银氨溶液后水浴加热 | 无银镜生成 | 不能判断淀粉是否水解 |
| A. | A | B. | B | C. | C | D. | D |
19.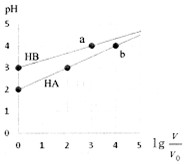 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
 室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )
室温下,浓度均为0.1mol•L-1、体积均为V0HA、HB溶液,分别加水稀释至V,pH随lg$\frac{V}{{V}_{0}}$的变化如图所示,下列说法正确的是( )| A. | HA为强酸,HB为弱酸 | |
| B. | 水的电离程度a点大于b点 | |
| C. | 当pH=2时,HA溶液中$\frac{c(HA)}{c({A}^{-})}$=9 | |
| D. | 等浓度等体积的HB与Na0H溶液充分反应后,离子浓度关系大小为:c(B-)>c(Na+)>c(H+)>c(OH-) |
16.NA表示阿伏伽德罗常数的值,下列叙述不正确的是( )
| A. | 60g SiO2晶体含4NA个σ键 | |
| B. | 1mol[Cu(NH3)4]2+中含4NA配位键 | |
| C. | 在24g石墨中,含C-C共价键数目为6NA | |
| D. | CO和N2是等电子体,标况下22.4L的CO气体与1mol N2所含的电子数相等 |