题目内容
1.下列装置能达到相应实验目的是( )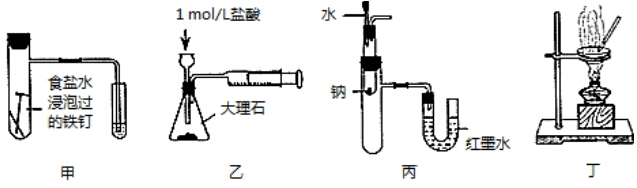
| A. | 用图甲装置验证铁发生析氢腐蚀 | |
| B. | 用图乙装置测定反应速率 | |
| C. | 用图丙装置验证Na和水反应的热效应 | |
| D. | 用图丁装置蒸干MgCl2溶液制备无水MgCl2 |
分析 A.铁在食盐水中发生吸氧腐蚀;
B.气体从长颈漏斗逸出;
C.Na和水反应放热,U形管液面发生变化;
D.加热MgCl2溶液,得到氢氧化镁固体.
解答 解:A.铁在中性的食盐水中发生吸氧腐蚀,发生析氢腐蚀,应在酸性条件下,故A错误;
B.气体从长颈漏斗逸出,不能完成实验,应用分液漏斗,故B错误;
C.Na和水反应放热,试管内温度升高,压强增大,则U形管液面发生变化,可完成实验,故C正确;
D.氯化镁水解,加热MgCl2溶液,得到氢氧化镁固体,故D错误.
故选C.
点评 本题考查较为综合,涉及金属的腐蚀、速率的测定、反应热的判断以及盐类的水解等知识,为高考常见题型和高频考点,侧重考查学生的分析能力和实验能力,注意把握实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
10.W、X、Y、Z是短周期中的常见元素,其部分性质如表,下列说法不正确的是( )
| W | 某种氧化物是淡黄色固体 |
| X | 短周期中最高价氧化物对应水化物酸性最强 |
| Y | 第三周期中离子半径最小的 |
| Z | 原子最外层电子数是电子总数的$\frac{2}{3}$ |
| A. | W、Y、X的原子半径依次减小,Y、W、X简单离子的半径依次增大 | |
| B. | W、X、Y的最高价氧化物的水化物之间可以两两反应 | |
| C. | W的氧化物与Z的最高价氧化物反应一定是氧化还原反应 | |
| D. | 金属性W比Y强,非金属性Z比X弱 |
12.下列反应中,氧元素被还原的是( )
| A. | 2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2 | B. | Na2O+H2O═2NaOH | ||
| C. | 2F2+2H2O═4HF+O2 | D. | 2C+SiO2$\frac{\underline{\;高温\;}}{\;}$2CO↑+Si |
9.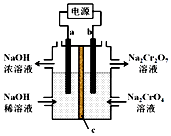 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
 根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )
根据反应2CrO42-+2H+?Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是( )| A. | a连接电源负极 | |
| B. | b极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c为阳离子交换膜 | |
| D. | 通过2 mol电子时生成1 mol Cr2O72- |
16.提出杂化轨道理论的科学家是( )
| A. | 泡利 | B. | 洪特 | C. | J•K罗林 | D. | 鲍林 |
5.常温下,pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液中水的电离程度大小关系是( )
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法判断 |
12.某化工厂产生含CN-浓度较高的废水,通过电解法 (以石墨为阳极,铁为阴极并加入少量NaCl进行电解)处理可大大降低废水中CN-含量.下列说法中正确的是( )
| A. | 该废水中可能含有较多的Fe2+、Fe3+ | |
| B. | 此电解法缺点之一是会产生少量氯气 | |
| C. | 阳极反应式为2CN--10e-+3H2O=CO2↑+N2↑+6H+ | |
| D. | 电解法处理后的废水pH减小 |
8.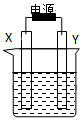 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
8.常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |