题目内容
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
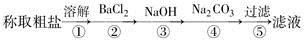

(1)判断BaCl2已过量的方法是___________________________。
(2)第④步中,相关的化学方程式是__________________________________。
(3)配制NaCl溶液时,若出现下列操作,其结果偏高还是偏低?
A.称量时NaCl已潮解( )
B.天平的砝码已锈蚀( )
C.定容时俯视刻度线( )
练习册系列答案
相关题目
8.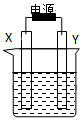 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
 如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )
如图装置中X和Y均为石墨电极,电解液为500mL某CuCl2溶液,电解时X电极表面有红色固体生成,Y电极有气体产生.一段时间后,取出X电极,洗涤、干燥、称量,电极增重1.6g.下列有关说法中正确的是( )| A. | X电极连接电源正极 | B. | 生成气体体积为0.56L | ||
| C. | Y电极上发生氧化反应 | D. | 该CuCl2溶液浓度为0.05mol/L |
8.常温下,将0.1L0.2mol/LKMnO4酸性溶液与一定量pH=3的草酸(HOOC-COOH)溶液混合,放出VL气体.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | pH=3的草酸溶液含有H+数目为0.001NA | |
| B. | 当1molKMnO4被还原时强酸提供H+数目为NA | |
| C. | 1molHOOC-COOH含共用电子对数目为9NA | |
| D. | 该反应释放CO2分子数目为$\frac{V}{22.4}$NA |



 2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )
2NO+O2在恒容的密闭容器中进行,达到平衡状态的标志是( )