题目内容
19.氨在国民经济中占有重要地位.(1)工业合成氨时,合成塔中每产生1mol NH3,放出46.1kJ的热量.
①工业合成氨的热化学方程式是N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol.
②已知:N2(g)$\underset{\stackrel{945.8kJ•mo{l}^{-1}}{→}}{\;}$2N(g)
H2(g)$\underset{\stackrel{436.0kJ•mol}{→}}{\;}$2H(g)
则断开1mol N-H键所需的能量是391kJ.
(2)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料.电池的总反应为:4NH3(g)+3O2(g)=2N2(g)+6H2O(g).则该燃料电池的负极反应式是2NH3-6e-+6OH-=N2+6H2O.
分析 (1)①先求出此反应的焓变,根据热化学方程式的书写规则再写出热化学方程式;
②根据反应热等于反应物的总键能减去生成物的总键能计算;
(2)依据氧化还原反应元素化合价变化分析判断,电池中负极上是氨气失电子生成氮气的反应.
解答 解:(1)①反应物总能量大于生成物总能量,应为放热反应,生成1mol氨气放出46.1kJ热量,则反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol;
②反应热等于反应物的总键能减去生成物的总键能,设N-H的键能为x,则945.8+3×436-6x=-92.2,x=391;
故答案为:391;
(2)原电池中负极失电子,氨气中氮元素化合价升高,发生氧化反应,该燃料电池的负极电极反应为:2NH3-6e-+6OH-=N2+6H2O;
故答案为:2NH3-6e-+6OH-=N2+6H2O.
点评 本题考查了热化学方程式和盖斯定律的分析应用,原电池原理的理解和电极反应的书写方法,题目难度中等.

练习册系列答案
 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案
相关题目
8.同主族元素形成的同一类型化合物,往往其结构和性质相似.PH4I 是一种白色晶体,下 列对 PH4I 的叙述中,正确的是( )
| A. | 它是一种共价化合物 | B. | 它受热时,不能分解产生有色气体 | ||
| C. | 它不可能与 NaOH 溶液反应 | D. | 它既含离子键又含共价键 |
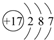 .
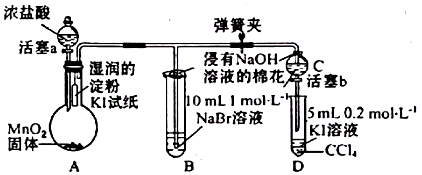
.
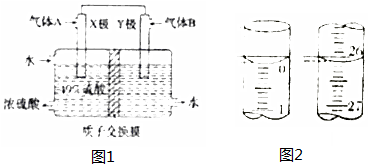
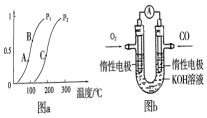 开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.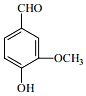 香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题:
香荚兰豆的香气成分中含有的香草醛(如图)也称香兰素,常用做食品添加剂的原料,起着增香作用.请回答下列问题: