题目内容
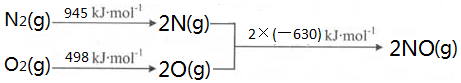
14.工业废气中含有一定量的SO2对空气产生严重的污染,对SO2的综合治理并且变废为宝有重要的意义.(1)已知:25℃、101kPa时,Mn(s)+O2(g)=MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)=SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)=MnSO4(s)△H=-1065kJ•mol-1
SO2与MnO2反应生成无水MnSO4的热化学方程式是MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol.
(2)富集废气中SO2,并使其与O2反应制备硫酸,用多孔电极材料,装置如图1所示.
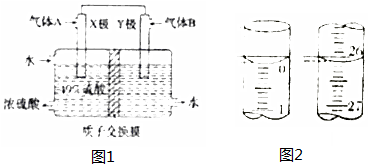
①X极的电极反应式为SO2-2e-+2H2O=SO42-+4H+.
②消耗11.2L(标准状况)气体B时,通过质子交换膜的H+的个数为2NA.
(3)用氢氧化钠吸收SO2可得到NaHSO3溶液,已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+H2O?H2SO3+OH- HSO3-?H++SO32-,向0.1mol•L-1的NaHSO3溶液中加入少量氢氧化钠固体,则$\frac{c(S{O}_{3}^{2-})}{c(HS{O}_{3}^{-})}$增大(填“增大”、“减小”或“不变,下同),$\frac{c(N{a}^{+})}{c(S{O}_{3}^{2-})}$增大.
(4)取20.00ml含NaHSO3的吸收液,用0.500mol/L的高锰酸钾溶液测定吸收液中NaHSO3的浓度,回答下列问题:
①盛装高锰酸钾溶液的滴定管为酸式滴定管,若滴定开始和结束时,滴定管中的液面如图2所示,所用盐酸消耗高锰酸钾溶液的体积为26.10ml.
②达到滴定终点的依据是滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;.
③吸收液中NaHSO3的浓度为1.631mol/L.
分析 (1)根据盖斯定律解题;
(2)①据X极为负极失电子发生氧化反应;
②据正极的电极反应方程式O2+4H++4e-=2H2O中的氧气求氢离子的个数;
(3)加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,抑制水解平衡,据此分析;
(4)①据高锰酸钾溶液为酸性分析;根据滴定管的结构和精确度以及测量的原理;
②达到滴定终点的依据是,滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
③根据高锰酸钾和亚硫酸氢钠之间的关系式计算亚硫酸氢钠的物质的量浓度.
解答 解:(1)Mn(s)+O2(g)═MnO2(s)△H=-520kJ•mol-1
S(s)+O2(g)═SO2(g)△H=-297kJ•mol-1
Mn(s)+S(s)+2O2(g)═MnSO4(s)△H=-1065kJ•mol-1
将③-②-①可得MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol,
故答案为:MnO2(s)+SO2(g)=MnSO4(s)△H=-248kJ/mol;
(2)①X极为负极失电子发生氧化反应,故电极反应方程式为SO2-2e-+2H2O=SO42-+4H+,
故答案为:SO2-2e-+2H2O=SO42-+4H+;
②正极的电极反应方程式O2+4H++4e-=2H2O
22.4L 4NA
11.2L 2NA
则N(H+)=2NA,
故答案为:2NA;
(3)加入氢氧化钠,消耗溶液中的氢离子,促进电离平衡右移,则c(SO32-)增大,所以$\frac{c(S{{O}_{3}}^{2-})}{c(HS{{O}^{-}}_{3})}$的值增大,加NaOH,溶液中钠离子浓度增大,由于钠离子浓度增大的程度大于c(SO32-)增大程度,所以溶液中 $\frac{C(N{a}^{+})}{C(S{{O}_{3}}^{2-})}$的值增大;
故答案为:增大;增大;
(4)高锰酸钾溶液为酸性,故用酸式滴定管;滴定管小刻度在上,大刻度在下,精确值为0.01mL,起始读数为0.00mL,终点读数为26.10mL,盐酸溶液的体积为26.10mL.
故答案为:酸;26.10;
②达到滴定终点的依据是,滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
故答案为:滴加最后一滴高锰酸钾标准液,溶液恰好由无色变为浅红色且30s不褪色;
③设亚硫酸氢钠的物质的量浓度为xmol/L.
2MnO4-+5HSO3-+H+=2Mn2++5SO42-+3H2O.
2mol 5mol
0.0261L×0.5mol•L-1 0.02xmol 解得:x=1.631mol/L,故NaHSO3的浓度为1.631mol/L,
故答案为:1.631mol/L.
点评 本题考查了热化学方程式的书写,电极方程式书写,滴定终点判断,本题难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 绿色植物的光合作用是把热能转化为化学能的过程 | |
| B. | 生物能是与化学反应无关的一种能源 | |
| C. | 化学能只能以热能的形式释放 | |
| D. | 葡萄糖在人体内的氧化是放热反应 |
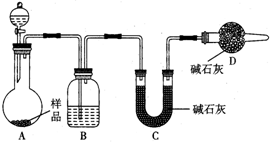 为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案:
为测定放置已久的小苏打样品中纯碱的质量分数,设计如下实验方案: