题目内容
8.某化学小组欲以CO2主要为原料,采用下图所示装置模拟“侯氏制碱法”制取NaHCO3,并对CO2与NaOH的反应进行探究.请你参与并完成对有关问题的解答.[资料获悉]
1.“侯氏制碱法”原理:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,然后再将NaHCO3制成Na2CO3.
2.Na2CO3与盐酸反应是分步进行:Na2CO3先与盐酸反应生成NaHCO3;然后再发生NaHCO3+HCl═NaCl+H2O+CO2↑
[实验设计]
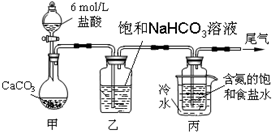
[实验探究]
(1)装置乙的作用是除去CO2中的HCl.
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有过滤、洗涤、灼烧.NaHCO3转化为Na2CO3的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑.
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示.
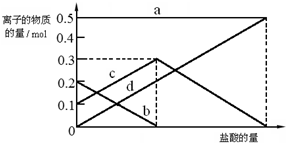
则曲线c对应的溶液中的离子是HCO3-(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是1:2.
(4)若将装置甲产生的纯净的CO22.24L(标准状况下)通入100mLNaOH溶液中,充分反应后,将溶液小心蒸干,得到不含结晶水的固体W,其质量为10.16g,则W的成分为Na2CO3和NaHCO3(填化学式),原NaOH溶液的物质的量浓度为0.18mol/L.
分析 (1)装置甲是制备二氧化碳,气体中含有氯化氢气体对后续实验产生干扰,需要除去;
(2)依据分离固体与液体采用的实验操作分析解答;NaHCO3转化为Na2CO3的方法是固体加热分解;
(3)混合物是碳酸钠和碳酸氢钠,滴入盐酸发生反应CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;依据图象分析碳酸根离子减小,碳酸氢根离子增多;
(4)根据CO2与NaOH的反应所得产物的可能性来讨论.
解答 解:(1)装置甲是制备二氧化碳气体的反应装置,生成的二氧化碳气体中含有氯化氢气体,对制备碳酸氢钠有影响,装置乙的作用是吸收氯化氢气体,
故答案为:除去CO2中的HCl;
(2)分离出NaHCO3晶体的操作是分离固体与液体,常采用的实验操作是过滤操作,碳酸氢钠受热分解生成二氧化碳、碳酸钠、水,反应为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,
故答案为:过滤;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g 完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,发生反应 CO32-+H+=HCO3-; HCO3-+H+=CO2↑+H2O;溶液中有关离子的物质的量的变化为碳酸根离子减小,碳酸氢根离子浓度增大,当碳酸根离子全部转化为碳酸氢根离子,再滴入盐酸和碳酸氢根离子反应生成二氧化碳,碳酸氢根离子减小,所以c曲线表示的是碳酸根氢离子浓度变化,碳酸根离子浓度0.2mol/L;碳酸氢根离子浓度为0.1mol/L,样品中NaHCO3和Na2CO3物质的量之比是1:2;
故答案为:HCO3-;1:2;
(4)CO22.24L(标准状况下)即为0.1mol,CO2与NaOH溶液反应时,根据NaOH是否过量,分情况讨论:
若NaOH过量或恰好完全反应,0.1molCO2与NaOH反应后生成0.1molNa2CO3,则Na2CO3的质量m=nM=0.1mol×106g/mol=510.6g>10.16g,故假设不成立;说明NaOH不能过量,即所得的固体中为Na2CO3或NaHCO3或两者的混合物.
设所得的固体中Na2CO3的物质的量为Xmol,NaHCO3的物质的量为Ymol,
根据碳元素的守恒可有:X+Y=0.1mol①
根据所得固体的质量为10.16g可有:106X+84Y=10.16g②
解得X=0.08mol Y=0.02mol
故所得的固体中既含Na2CO3又含NaHCO3;
根据所得固体中Na2CO3为0.08mol,NaHCO3为0.02mol,根据钠元素的守恒可知,NaOH的物质的量n=0.08mol×2+0.02mol×2=0.18mol,
故NaOH的物质的量浓度C=$\frac{n}{V}$=$\frac{0.18mol}{0.1L}$=0.18mol/L,
故答案为:Na2CO3和NaHCO3; 0.18 mol/L.
点评 本题考查了 工业制纯碱的原理分析,生产过程中的物质变化,混合物成分的分析判断和计算应用,实验过程分析,除杂操作,尾气吸收,图象定量分析判断,题目难度中等.

| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑤③① | D. | ①②③⑤ |
| A. | 熔融MgCl2、熔融NaOH | B. | 盐酸、石灰水 | ||
| C. | 石墨、食醋 | D. | 稀硫酸、蔗糖 |
| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA | |
| C. | 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
| A. | 增大C的浓度 | B. | 增大压强 | C. | 升高温度 | D. | 加催化剂 |
 在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )
在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )| 选项 | x | y |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 压强 | S2气体体积分数 |
| C | 容器体积 | H2S浓度 |
| D | O2浓度 | 平常常数逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 可能存在大量Ba2+ | B. | 溶液中Na+物质的量小于0.12mol | ||
| C. | 可能存在Cl- | D. | 溶液中c(Na+)≥0.6mol•L-1 |
| A. | Na→NaOH→Na2CO3 | B. | NaCl→Cl2→Fe Cl3 | ||
| C. | CO→CO2→C | D. | Al2O3→Al(OH)3→AlCl3 |
 将0.1mol的镁、铝混合物溶于100mL 2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答:
将0.1mol的镁、铝混合物溶于100mL 2mol•L-1的H2SO4溶液中,然后再滴加1mol•L-1的NaOH溶液.请回答: