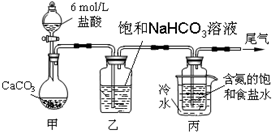
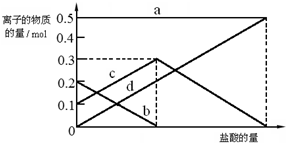
题目内容
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,11.2 L Cl2通入含0.5molFeBr2的溶液中转移电子数为1.5NA | |
| B. | 0.1 mol•L-1的AlCl3溶液与足量NaOH溶液反应所得产物中含AlO2-为0.1NA | |
| C. | 足量Zn与浓硫酸共热可生成标准状况下的气体2.24 L,则参加反应的硫酸为0.4 NA | |
| D. | 常温常压下,1.6g甲烷中含有的碳原子数为0.1NA |
分析 A、Fe2+和Br-均能被氯气氧化;
B、溶液体积不明确;
C、锌能与稀硫酸反应;
D、求出甲烷的物质的量,然后根据1mol甲烷中含1mol碳原子来分析.
解答 解:A.Fe2+和Br-均能被氯气氧化,故当0.5molFeBr2被氧化完全时,需要1.5mol氯气.而标况下11.2 L Cl2的物质的量为0.5mol,故氯气的量不足,完全反应,故最多失去1mol电子,故A错误;
B.不知道溶液的体积,无法计算AlCl3溶液的物质的量,故B错误;
C.锌既能与浓硫酸反应又能与稀硫酸反应,故生成的气体中既有二氧化硫又有氢气,故参加反应的硫酸小于0.4 NA,故C错误;
D、1.6g甲烷的物质的量为0.1mol,而1mol甲烷中含1mol碳原子,故0.1mol甲烷中含0.1mol碳原子即0.1NA个,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.下列叙述不正确的是( )
| A. | 丁达尔效应可以区别溶液和胶体 | |
| B. | NaHCO3溶液中含有少量Na2CO3,可以用澄清石灰水除去 | |
| C. | 金属铝的生产是以Al2O3为原料,在熔融状态下进行电解 | |
| D. | 向品红溶液中通入SO2气体红色褪去,再加热恢复红色 |
14.可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、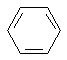 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )
 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )| A. | FeCl2溶液 | B. | NaOH溶液 | C. | 水 | D. | 溴水 |
11.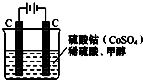 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为2.24L.
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
18.在含2mol H2SO4的浓硫酸中加入足量的Zn粉,使其充分反应,则下列推断中正确的是( )
①放出的气体除了SO2外,还有H2;
②只放出了SO2气体,其物质的量为1mol;
③反应结束时产生气体的物质的量一定小于2mol;
④在反应中硫酸全部起氧化性作用;
⑤转移电子为2NA.
①放出的气体除了SO2外,还有H2;
②只放出了SO2气体,其物质的量为1mol;
③反应结束时产生气体的物质的量一定小于2mol;
④在反应中硫酸全部起氧化性作用;
⑤转移电子为2NA.
| A. | ①③ | B. | ①③④ | C. | ②③ | D. | ②④⑤ |
15.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W的氢化物的稳定性比X的氢化物稳定性强 | |
| B. | 元素Y的最高价氧化物对应水化物为强碱 | |
| C. | 化合物YX、ZX2、WX2中化学键类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
18.被称为“软电池”的纸质电池,采用一个薄层纸片(在其一边镀锌,在其另一边镀二氧化锰)作为传导体.在纸内的离子“流过”水和氧化锌组成的电解液.电池总反应为Zn+2MnO2+H2O═ZnO+2MnO(OH)下列说法不正确的是( )
| A. | 当该电池消耗1mol锌时,与CH4燃料电池消耗0.25molCH4产生电量相等 | |
| B. | 该电池二氧化锰为正极,发生氧化反应 | |
| C. | 当0.1mol Zn完全溶解时,电池外电路转移的电子个数约为1.204×1023 | |
| D. | 电池正极反应式为MnO2+e-+H2O═MnO(OH)+OH- |