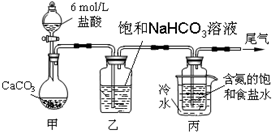
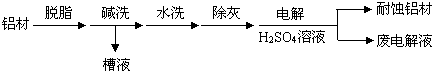
题目内容
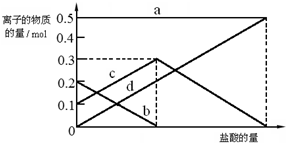
20. 在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )
在某密闭容器中充入H2S和O2,发生反应:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,达到平衡后,若仅改变横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势符合图象的是( )| 选项 | x | y |
| A | 温度 | 混合气体平均相对分子质量 |
| B | 压强 | S2气体体积分数 |
| C | 容器体积 | H2S浓度 |
| D | O2浓度 | 平常常数逆反应速率 |
| A. | A | B. | B | C. | C | D. | D |
分析 反应是气体体积不变的放热反应;
A、若x为温度,随温度升高平衡逆向进行,气体质量不变,体积不变,密度不变;
B、若x为压强,随压强增大,平衡不移动;
C、若x为容器的体积,随体积增大,各组分的浓度减小;
D、平衡常数只随温度变化,不随浓度变化.
解答 解:2H2S(g)+O2(g)?S2(g)+2H2O(g)△H<0,反应是气体体积不变的放热反应;
A、若x为温度,随温度升高平衡逆向进行,气体质量不变,体积不变,密度不变,图象曲线变化趋势错误,故A不符合;
B、若x为压强,随压强增大,平衡不移动,气体的体积分数不变,图象变化趋势错误,故B不符合;
C、若x为容器的体积,随体积增大,各组分的浓度减小,图象变化趋势正确,故C符合;
D、平衡常数只随温度变化,不随浓度变化,图象变化错误,故D不符合;
故选C.
点评 本题考查了化学平衡影响因素分析判断,注意平衡常数随温度变化,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11. (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为2.24L.
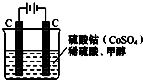
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
15.短周期元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子总数的3倍,Y原子的最外层只有2个电子,Z单质可制成半导体材料,W与X属于同一主族.下列叙述正确的是( )
| A. | 元素W的氢化物的稳定性比X的氢化物稳定性强 | |
| B. | 元素Y的最高价氧化物对应水化物为强碱 | |
| C. | 化合物YX、ZX2、WX2中化学键类型相同 | |
| D. | 原子半径的大小顺序:rY>rZ>rW>rX |
5.能证明氟化氢是弱电解质的事实是( )
| A. | 氟化氢在所有卤化氢中热稳定性最强 | |
| B. | 浓H2SO4加入氟化钙固体中,加热,有氟化氢气体产生 | |
| C. | 100ml 0.1 mol•Lˉ1氢氟酸中,c(H+)小于0.1 mol•Lˉ1 | |
| D. | 测得常温下0.1mol•L-1NaF溶液的pH>7 |
14.设NA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 标准状况下,22.4 L 氯水中含有的分子数为NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2CO3溶液中CO32-的数目为NA | |
| D. | 2.3 g金属钠与足量的氧气反应,无论加热与否转移电子数均为0.1NA |
 CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空:
CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空: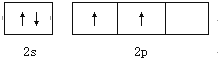 .
. ;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.