题目内容
19.为证明溴乙烷中含有溴元素,向溴乙烷中依次加入下列药品并加热,操作步骤中正确的是①加入硝酸银溶液 ②加入氢氧化钠溶液或加入氢氧化钠醇溶液③加热④加入蒸馏水⑤加入稀硝酸至溶液呈酸性( )| A. | ④③①⑤ | B. | ②③⑤① | C. | ④⑤③① | D. | ①②③⑤ |
分析 溴乙烷中不含溴离子,要检验溴元素的存在,应先发生水解反应,然后加酸中和至酸性,最后加硝酸银,以此来解答.
解答 解:证明溴乙烷中溴元素的存在,先发生②加入氢氧化钠溶液并③加热,发生水解反应生成NaBr,
再发生⑤加入稀硝酸至溶液呈酸性,
最后①加入硝酸银溶液,生成淡黄色沉淀,则证明含溴元素,
即操作顺序为②③⑤①,
故选B.
点评 本题考查物质的检验及离子的检验,为高频考点,注意溴乙烷中不含溴离子,明确官能团-Br的水解反应是解答的关键,水解后加酸至酸性为解答的易错点,题目难度不大.

练习册系列答案
相关题目
9. 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
 咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如图所示,关于咖啡鞣酸的下列叙述正确的是( )| A. | 分子式为C16H13O9 | |
| B. | 与浓溴水既能发生取代反应又能发生加成反应 | |
| C. | 1 mol咖啡鞣酸水解时可消耗8 mol NaOH | |
| D. | 能使酸性KMnO4溶液褪色,说明分子结构中有碳碳双键 |
7.某温度时,在容积为2L的三个恒容密闭容器中发生反应3A(g)+B(g)?xC(g),按不同方式投入反应物,测得反应达到平衡时的有关数据如下:
下列说法正确的是( )
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 3mol A,2mol B | 6molA.4mol B | 2mol C |
| 达到平衡的时间/时间 | 5 | 8 | |
| A的平衡浓度/mol•L-1 | c1 | c2 | |
| C的体积分数/% | ω1 | ω2 | ω3 |
| 混合气体的密度/g•L-1 | ρ1 | ρ2 |
| A. | 若x>4,2c1<c2 | |
| B. | 若x=4,则ω1=ω2=ω3 | |
| C. | 只有当x=4时,2ρ1=ρ2 | |
| D. | 容器甲达到平衡所需的时间比容器乙达到平衡所需的时间长 |
14.可以将五种无色液体:C2H5OH、AgNO3溶液、C2H5Br、 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )
 、KI溶液一一区分开的试剂是( )
、KI溶液一一区分开的试剂是( )| A. | FeCl2溶液 | B. | NaOH溶液 | C. | 水 | D. | 溴水 |
11. (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象),阳极上收集到氧气标况下的体积为2.24L.
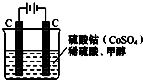
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
 (1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.
(1)甲醇(CH3OH)是重要的能源物质,研究甲醇具有重要意义.为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2-.电池工作时正极反应式为O2+4e-=2O2-.若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl- | SO42- |
| c/mol•L-1 | 1 | 4 | 4 | 1 |
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.实验室用图装置模拟上述过程:
①写出阳极电极反应式Co2+-e-=Co3+;
②除去甲醇的离子反应为6Co3++CH3OH+H2O=CO2↑+6Co2++6H+,该过程中被氧化的元素是C,当产生标准状况下2.24L CO2时,共转移电子0.6mol.
14.设NA表示阿伏加德罗常数的数值,下列有关说法正确的是( )
| A. | 标准状况下,22.4 L 氯水中含有的分子数为NA | |
| B. | 25℃时,pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 1L 1mol•L-1的Na2CO3溶液中CO32-的数目为NA | |
| D. | 2.3 g金属钠与足量的氧气反应,无论加热与否转移电子数均为0.1NA |
 CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空:
CO2和CH4在一定条件下合成乙酸:CO2+CH4$\stackrel{TiO_{2}/Cu_{2}Al_{2}O_{4}}{→}$CH3COOH.完成下列填空: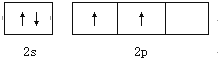 .
. ;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大.
;其熔沸点比CO2高,原因是二者都为分子晶体,相对分子质量越大,分子间作用力越大. 
