题目内容
在一定条件下,C(s)+H2O(g)?CO(g)+H2(g)△H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图象正确的是( )
A、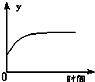 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、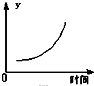 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、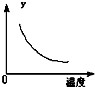 表示反应达到平衡后,升高温度CO的百分含量的变化 |
考点:化学平衡的影响因素
专题:图示题,化学平衡专题
分析:A.H2O的相对分子质量为18,H2和CO的平均相对分子质量为
=15,故平均相对分子质量先逐渐减小,后保持不变;
B.密度=
,总质量先逐渐增大,后保持不变,体积不变,故密度先逐渐增大,后保持不变;
C.移去一些焦炭对平衡不产生影响;
D.升高温度,平衡正向移动.
| 2+12+16 |
| 2 |
B.密度=
| 总质量 |
| 体积 |
C.移去一些焦炭对平衡不产生影响;
D.升高温度,平衡正向移动.
解答:
解:C(s)+H2O(g)?CO(g)+H2(g)△H>0
A.H2O的相对分子质量为18,H2和CO的平均相对分子质量为
=15,故平均相对分子质量先逐渐增大,后保持不变,故A错误;
B.密度=
,总质量先逐渐增大,后保持不变,体积不变,故密度先逐渐增大,后保持不变,故B正确;
C.移去一些焦炭对平衡不产生影响,故水蒸气的百分含量保持不变,故C错误;
D.升高温度,平衡正向移动,CO的百分含量增大,故D错误;
故选B.
A.H2O的相对分子质量为18,H2和CO的平均相对分子质量为
| 2+12+16 |
| 2 |
B.密度=
| 总质量 |
| 体积 |
C.移去一些焦炭对平衡不产生影响,故水蒸气的百分含量保持不变,故C错误;
D.升高温度,平衡正向移动,CO的百分含量增大,故D错误;
故选B.
点评:本题考查混合气体的平均相对分子质量和密度变化的判断、化学平衡的影响因素,难度中等.要注意平衡移动原理的正确运用.

练习册系列答案
相关题目
在金属钠与水反应的实验中不能反映出钠的性质是( )
| A、良导体 | B、还原性强 |
| C、密度小 | D、熔点低 |
有下列一整套电化学装置,关于该装置说法正确的是( )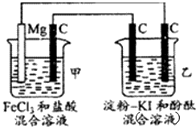

| A、甲池中Mg极为阳极,电极反应式为:Mg-2r-═Mg2+ |
| B、甲池中:当Mg减少2.4g时,石墨(C)极上产生2.24L气体 |
| C、乙池中将化学能转化为电能 |
| D、乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红 |
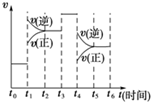 反应N2(g)+3H2(g)
反应N2(g)+3H2(g)
| ||
| △ |
| A、t0~t1 |
| B、t2~t3 |
| C、t3~t4 |
| D、t5~t6 |
工业上可以用二氧化碳与氢气在催化剂的作用下反应生成甲醇,反应方程式为:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |
用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A、含有NA个氢原子的氢气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、在常温常压下,35.5g Cl2含有的分子数为0.5NA |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
在下列各项中,化学反应前后肯定没有发生改变的是( )
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
①原子的数目
②分子的数目
③元素的种类
④物质的总质量
⑤物质的种类
⑥原子的种类.
| A、①③④⑤ | B、①③④⑥ |
| C、①④⑥ | D、①③⑤ |


