题目内容
在金属钠与水反应的实验中不能反映出钠的性质是( )
| A、良导体 | B、还原性强 |
| C、密度小 | D、熔点低 |
考点:钠的化学性质
专题:金属概论与碱元素
分析:钠的密度小于水,钠的熔点较低,钠和水剧烈反应生成氢氧化钠和氢气,且反应放出大量的热,氢氧化钠溶液呈碱性,紫色石蕊试液遇碱变蓝色.
解答:
解:A.钠和水反应现象中不能说明钠易导电,故A选;
B.钠能和冷水反应说明钠的性质很活泼,容易失去电子,还原性强,故B不选;
C.钠浮在水面上,说明钠的密度小于水,故C不选;
D.钠和水反应放出的热量使钠熔成小球,说明钠的熔点低,故D不选;
故选A.
B.钠能和冷水反应说明钠的性质很活泼,容易失去电子,还原性强,故B不选;
C.钠浮在水面上,说明钠的密度小于水,故C不选;
D.钠和水反应放出的热量使钠熔成小球,说明钠的熔点低,故D不选;
故选A.
点评:本题考查了钠和水的反应,根据钠和水的反应现象确定钠的性质,钠是很活泼的金属,易和水、氧气反应,题目难度不大.

练习册系列答案
相关题目
下列说法中不正确的是( )
| A、CH3CBr(OH)CH2OH是手性分子 |
| B、HF、HCl、HBr、HI的热稳定性依次减弱 |
| C、F2、C12、Br2、I2的熔、沸点逐渐升高 |
| D、邻羟基苯甲醛的熔点比对羟基苯甲醛高 |
下列有关实验原理、方法和结论都正确的是( )
| A、向某FeCl2溶液中加入Na2O2粉末,出现红褐色沉淀,说明原FeCl2溶液已氧化变质 |
| B、取少量溶液X,加入适量新氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、粗略配制2mol?L-1的NaCl溶液,称58.5g NaCl,加入到盛有500mL水的烧杯中,搅拌、溶解 |
| D、溶液X中通入足量CO2,未看到白色沉淀,则说明原溶液中一定不存在大量Ca2+或Ba2+ |
在集气瓶中使用甲烷与氧气混合,点燃,进行爆炸性试验,下列甲烷与氧气的体积比中爆炸声最大的是( )
| A、1:1 | B、1:2 |
| C、1:3 | D、3:1 |
 2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完
2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完全燃烧生成氮气、二氧化碳和液态水放出热量50kJ.下列有关热化学方程式正确的是( )
| A、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ?mol-1 |
| B、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ?mol-1 |
| C、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ?mol-1 |
| D、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ?mol-1 |
用下列实验装置进行相应实验,能达到实验目的是( )
A、 验证Na和水反应放热 |
B、 将溶液定容到100mL |
C、 分离酒精和水 |
D、 检查装置的气密性 |
下列说法正确的是( )
| A、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| D、晶体中一定存在化学键 |
用下列实验装置进行的实验中,不能达到相应实验目的是( )
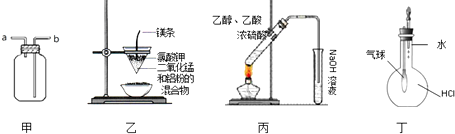

| A、装置甲:气体从a口进入,收集NH3 |
| B、装置乙:可制得金属锰 |
| C、装置丙:实验室制取乙酸乙酯 |
| D、装置丁:验证HCl气体在水中的溶解性 |
在一定条件下,C(s)+H2O(g)?CO(g)+H2(g)△H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图象正确的是( )
A、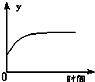 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、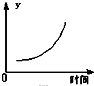 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、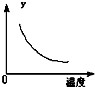 表示反应达到平衡后,升高温度CO的百分含量的变化 |