题目内容
用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
| A、含有NA个氢原子的氢气在标准状况下的体积约为11.2L |
| B、25℃,1.01×105Pa,64g SO2中含有的原子数为3NA |
| C、在常温常压下,35.5g Cl2含有的分子数为0.5NA |
| D、标准状况下,11.2L H2O含有的分子数为0.5NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.含有NA个氢原子的氢气的物质的量为0.5mol,标况下0.5mol氢气的体积为11.2L;
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有2mol氧原子、1mol硫原子,总共含有3mol原子;
C.35.5g氯气的物质的量为
=0.5mol=0.5mol;
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量.
B.64g二氧化硫的物质的量为1mol,1mol二氧化硫中含有2mol氧原子、1mol硫原子,总共含有3mol原子;
C.35.5g氯气的物质的量为
| 35.5g |
| 71g/mol |
D.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量.
解答:
解:A.含有NA个氢原子的氢气,其物质的量是0.5mol,标准状况下0.5mol氢气的体积为11.2L,故A正确;
B.64g二氧化硫的物质的量为:
=1mol,1molSO2中含有2molO原子、1molS原子,总共含有3mol原子,含有的原子数为3NA,故B正确;
C.35.5g Cl2的物质的量为:
=0.5mol,0.5mol氯气中含有的分子数为0.5NA,故C正确;
D.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量,故D错误;
故选D.
B.64g二氧化硫的物质的量为:
| 64g |
| 64g/mol |
C.35.5g Cl2的物质的量为:
| 35.5g |
| 71g/mol |
D.标况下,水不是气体,不能使用标况下的气体摩尔体积计算11.2L水的物质的量,故D错误;
故选D.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下水、乙醇、三氧化硫、氟化氢等的状态不是气体.

练习册系列答案
相关题目
用下列实验装置进行相应实验,能达到实验目的是( )
A、 验证Na和水反应放热 |
B、 将溶液定容到100mL |
C、 分离酒精和水 |
D、 检查装置的气密性 |
物质的量浓度、体积都相同的一元酸和一元碱恰好中和时,溶液将( )
| A、显酸性 | B、显中性 |
| C、显碱性 | D、无法确定酸碱性 |
下列离子方程式正确的是( )
| A、NaHSO4与过量的Ba(OH)2溶液反应:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
| B、碳酸氢铵溶液中加入过量氢氧化钠溶液 HCO3-+OH-=CO32-+H2O |
| C、碳酸镁溶于硝酸中:CO32-+2H+=H2O+CO2↑ |
| D、硫化钠溶于水中:S2-+2H2O=H2S↑+2OH- |
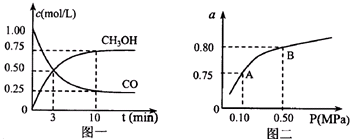
在一定条件下,C(s)+H2O(g)?CO(g)+H2(g)△H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图象正确的是( )
A、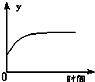 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、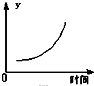 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、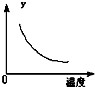 表示反应达到平衡后,升高温度CO的百分含量的变化 |
 如图,在密闭容器中反应:C(s)+H2O(g)?CO(g)+H2(g) (吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是( )
如图,在密闭容器中反应:C(s)+H2O(g)?CO(g)+H2(g) (吸热反应)达到平衡后,由于条件的改变而引起正、逆反应速率的变化,及平衡移动状况,则改变的条件是( )| A、增加CO浓度 | B、增大压强 |
| C、升高温度 | D、增加水蒸气 |