题目内容
有下列一整套电化学装置,关于该装置说法正确的是( )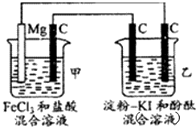

| A、甲池中Mg极为阳极,电极反应式为:Mg-2r-═Mg2+ |
| B、甲池中:当Mg减少2.4g时,石墨(C)极上产生2.24L气体 |
| C、乙池中将化学能转化为电能 |
| D、乙池左侧石墨电极附近变蓝,右侧石墨电极附近变红 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲装置中Mg、C和盐酸构成原电池,Mg失电子作负极,C作正极,正极上氢离子得电子生成氢气;乙为电解池,右边C与Mg相连为阴极,左边C与正极相连为阳极;根据电极反应结合选项分析.
解答:
解:甲装置中Mg、C和盐酸构成原电池,Mg失电子作负极,C作正极,正极上氢离子得电子生成氢气;乙为电解池,右边C与Mg相连为阴极,左边C与正极相连为阳极,
A、甲池中Mg极为负极,电极反应式为:Mg-2e-═Mg2+,故A错误;
B、甲池中:Mg极反应为Mg-2e-═Mg2+,C极反应为2H++2e-═H2↑,当Mg减少2.4g即0.1mol时,生成氢气为0.1mol,则在标准状况下为2.24L,题目中没有说明标准状况,故B错误;
C、乙装置为电解池,则乙池中将电能转化为化学能,故C错误;
D、乙池左侧石墨电极为阳极,阳极上碘离子失电子生成碘单质,则附近溶液变蓝,右侧石墨电极为阴极,阴极上氢离子得电子生成氢气同时溶液中生成氢氧根离子,则附近溶液变红,故D正确.
故选D.
A、甲池中Mg极为负极,电极反应式为:Mg-2e-═Mg2+,故A错误;
B、甲池中:Mg极反应为Mg-2e-═Mg2+,C极反应为2H++2e-═H2↑,当Mg减少2.4g即0.1mol时,生成氢气为0.1mol,则在标准状况下为2.24L,题目中没有说明标准状况,故B错误;
C、乙装置为电解池,则乙池中将电能转化为化学能,故C错误;
D、乙池左侧石墨电极为阳极,阳极上碘离子失电子生成碘单质,则附近溶液变蓝,右侧石墨电极为阴极,阴极上氢离子得电子生成氢气同时溶液中生成氢氧根离子,则附近溶液变红,故D正确.
故选D.
点评:本题考查了原电池原理和电解池原理的应用,注意把握电极的判断方法和电极方程式的书写,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列有关实验原理、方法和结论都正确的是( )
| A、向某FeCl2溶液中加入Na2O2粉末,出现红褐色沉淀,说明原FeCl2溶液已氧化变质 |
| B、取少量溶液X,加入适量新氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ |
| C、粗略配制2mol?L-1的NaCl溶液,称58.5g NaCl,加入到盛有500mL水的烧杯中,搅拌、溶解 |
| D、溶液X中通入足量CO2,未看到白色沉淀,则说明原溶液中一定不存在大量Ca2+或Ba2+ |
下列说法正确的是( )
| A、CaCl2、NaOH、HCl、HD四种物质都属于化合物 |
| B、蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| C、可用澄清石灰水鉴别Na2CO3溶液和NaHCO3溶液 |
| D、晶体中一定存在化学键 |
用下列实验装置进行的实验中,不能达到相应实验目的是( )
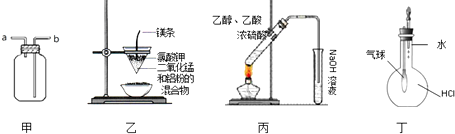

| A、装置甲:气体从a口进入,收集NH3 |
| B、装置乙:可制得金属锰 |
| C、装置丙:实验室制取乙酸乙酯 |
| D、装置丁:验证HCl气体在水中的溶解性 |
下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是( )
A、 溴丙烷消去并检验产物 |
B、 制取和收集氨气 |
C、 分离沸点不同的液体混合物 |
D、 制备乙烯 |
物质的量浓度、体积都相同的一元酸和一元碱恰好中和时,溶液将( )
| A、显酸性 | B、显中性 |
| C、显碱性 | D、无法确定酸碱性 |
一定温度下,将1mollCO与2molH2和催化剂一起放入容积恒定密闭容器中反应:CO(g)+2H2(g)?CH3OH.测得平衡时生成CH3OH0.65mol.若此时再通入H2 2mol.则重新达到平衡时,CH3OH的物质的量可能是( )
| A、0.65 | B、0.72 |
| C、1.00 | D、1.30 |
在一定条件下,C(s)+H2O(g)?CO(g)+H2(g)△H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图象正确的是( )
A、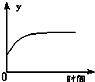 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、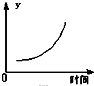 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、 表示反应达到平衡后,升高温度CO的百分含量的变化 |
