题目内容
工业上可以用二氧化碳与氢气在催化剂的作用下反应生成甲醇,反应方程式为:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
CO2(g)+3H2(g)═CH3OH(g)+H2O(g),C=O键能为a kJ/mol,H-H 键能为b kJ/mol,
C-O键能为c kJ/mol,H-C键能为d kJ/mol,H-O键能为e kJ/mol,则该反应的反应热为( )
| A、2a+3(b+d-e)+c kJ/mol |
| B、a+3(2b+d-e)-c kJ/mol |
| C、3(d+e-b)+c-2a kJ/mol |
| D、2a+3(b-d-e)-c kJ/mol |
| E、2a+3(b-d-e)-c kJ/mol |
考点:有关反应热的计算
专题:化学反应中的能量变化
分析:二氧化碳为直线型结构,分子中存在两个碳氧双键;1molCO2(g)中含有2mol碳氧双键,1molH2(g)中含有1mol氢氢单键,1molCH3OH(g)中含有3mol碳氢单键和1mol碳氧键、1mol氢氧键,1molH2O(g)中含有2mol氢氧单键,依据△H=反应物的总键能-生成物的总键能计算.
解答:
解:二氧化碳为直线型结构,二氧化碳的结构式为:O=C=O,1molCO2(g)中含有2mol碳氧双键键能为2akJ,1molH2(g)中含有1mol氢氢单键键能为bkJ,1molCH3OH(g)中含有3mol碳氢单键键能为3dkJ和1mol碳氧键键能为ckJ、1mol氢氧键键能为ekJ,1molH2O(g)中含有2mol氢氧单键键能为2ekJ,依据△H=反应物的总键能-生成物的总键能,则该反应的反应热为(2a+3b-3d-c-e-2e)kJ/mol=2a+3(b-d-e)-c kJ/mol,
故选D.
故选D.
点评:本题考查反应热的有关计算、键能与反应热的关系等,明确△H=反应物的总键能-生成物的总键能是解题的关键,题目难度中等.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
 2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完
2012年6月16日18时37分神舟九号飞船从酒泉卫星发射中心长征二号F型火箭发射升空,先后与天宫一号目标飞行器在轨成功进行了两次交会对接.长征二号F型火箭用的燃料是液体偏二甲基肼C2H8N2,氧化剂是液体N2O4,已知1.5g偏二甲基肼完全燃烧生成氮气、二氧化碳和液态水放出热量50kJ.下列有关热化学方程式正确的是( )
| A、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-50kJ?mol-1 |
| B、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-50kJ?mol-1 |
| C、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(l)△H=-2000kJ?mol-1 |
| D、C2H8N2(l)+2N2O4(l)=3N2(g)+2CO2(g)+4H2O(g)△H=-2000kJ?mol-1 |
下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是( )
A、 溴丙烷消去并检验产物 |
B、 制取和收集氨气 |
C、 分离沸点不同的液体混合物 |
D、 制备乙烯 |
一定温度下,将1mollCO与2molH2和催化剂一起放入容积恒定密闭容器中反应:CO(g)+2H2(g)?CH3OH.测得平衡时生成CH3OH0.65mol.若此时再通入H2 2mol.则重新达到平衡时,CH3OH的物质的量可能是( )
| A、0.65 | B、0.72 |
| C、1.00 | D、1.30 |
下列物质中属于晶体的是( )
| A、玻璃 | B、水晶 | C、水泥 | D、橡胶 |
在一定条件下,C(s)+H2O(g)?CO(g)+H2(g)△H>0在一容积固定的密闭容器中放入足量的焦炭与一定量的水蒸气进行反应,下列有关图象正确的是( )
A、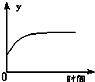 表示反应进行过程中气体平均相对分子质量的变化 |
B、 表示反应进行过程中气体密度的变化 |
C、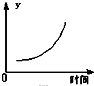 表示反应达到平衡后,移去一些焦炭后水蒸气的百分含量的变化(忽略表面积的影响) |
D、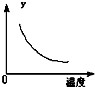 表示反应达到平衡后,升高温度CO的百分含量的变化 |
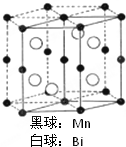 磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( )
磁光盘机(Magnetic Optical Disk Drive,MO)是一种可重写的光盘驱动器,它使用磁光盘片作存储媒体.磁光存储的研究是Williams等在1957年使Mn和Bi形成的晶体薄膜磁化并用光读取之后开始的.如图是该物质的晶体结构,其化学式可表示为( ) (1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)
(1)t℃时水的离子积为1×10-13,则该温度(选填大于、小于或等于)