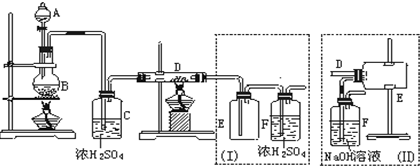
题目内容
16.欧盟定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫.请运用化学反应原理的相关知识研究碳及其化合物的性质.(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量.该反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1 .
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
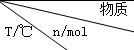 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2.
Ⅰ.K1=0.5625.(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,其负极反应式:2CO-4e-+2CO32-═4CO2,则正极反应式为:O2+2CO2+4e-=2CO32-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mo1/L.
分析 (1)12g碳的物质的量为1mol,与水蒸气完全反应生成CO、H2,吸收131.6kJ热量,据此结合热化学方程式书写原则进行书写;
(2)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2;
②Ⅰ、计算各气体的平衡浓度,代入平衡常数表达式计算;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,不能判断温度变化;
(3)n (CO2)=0.2mol,n(NaOH)=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,1<n(NaOH):n (CO2)<2,所以溶液中的溶质有碳酸钠、碳酸氢钠,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,
则得方程组:$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$解得:x=0.1,y=0.1,
溶液中的溶质为等物质的量的碳酸钠和碳酸氢钠,碳酸根水解程度大于碳酸氢根离子;
(4)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,得失电子相等时,正负极电极反应式相加即得电池反应式;
(5)根据溶度积常数计算氯化钙浓度.
解答 解:(1)12g碳的物质的量为1mol,与水蒸气反应生成CO、H2,吸收131.6kJ热量,该反应的热化学方程式C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1,
故答案为:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6 kJ•mol-1 ;
(2)①由表中数据可知,C、NO、E、F的化学计量数之比为0.03:0.06:0.03:0.03=1:2:1:1,反应中C被氧化,结合原子守恒可知,生成为N2与CO2,且该反应为可逆反应,故反应方程式为:C(s)+2NO(g)?N2(g)+CO2(g),
故答案为:C(s)+2NO(g)?N2(g)+CO2(g);
②Ⅰ、平衡时c(NO)=0.02mol/L,c(N2)=c(CO2)=0.015mol/L,故T1℃时该反应的平衡常数为K1=$\frac{0.015×0.015}{0.0{2}^{2}}$=0.5625,
故答案为:0.5625;
Ⅱ、由表中数据可知,温度由T1变为T2,平衡向逆反应移动,由于正反应是吸热,还是放热不确定,无法判断温度变化,故答案为:c;
(3)n (CO2)=0.2mol,n(NaOH)=0.3mol,则反应的可能方程式有:CO2+2NaOH=Na2CO3+H2O,CO2+NaOH=NaHCO3,1<n(NaOH):n (CO2)<2,所以溶液中的溶质有碳酸钠、碳酸氢钠,设所得产物中含Na2CO3为xmol,NaHCO3为ymol,
则得方程组:$\left\{\begin{array}{l}{x+y=0.2}\\{2x+y=0.3}\end{array}\right.$;
解得:x=0.1,y=0.1,
在含等物质的量的碳酸钠、碳酸氢钠的溶液中,c(Na+)最大,碳酸根离子水解大于碳酸氢根离子的水解,则c(HCO3-)>c(CO32-),
水解使溶液显碱性,则c(OH-)>c(H+),显性离子大于隐性离子,所以c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
即离子浓度大小为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);
(4)该燃料电池中,负极上电极反应式为2CO+2CO32--4e-=4CO2,正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+2CO2+4e-=2 CO32-,则电池反应式为2CO+O2=2CO2,故答案为:O2+2CO2+4e-=2 CO32-;
(5)混合溶液中碳酸根离子浓度为1×10-4mo1/L,混合溶液中c(Ca 2+ )=$\frac{{K}_{sp}}{c(C{{O}_{3}}^{2-})}$=$\frac{2.8×1{0}^{-9}}{1×1{0}^{-4}}$mol/L=2.8×10-5mo1/L,则原来溶液中c(CaCl2)=5.6×10-5mo1/L,故答案为:5.6×10-5mo1/L.
点评 本题考查较综合,涉及平衡常数的有关计算、离子浓度大小比较、原电池原理、热化学反应、氧化还原反应等知识点,为高频考点,根据基本公式、溶液中的溶质及守恒思想、原电池原理等知识点分析解答,注意(5)题两种溶液混合时,离子浓度降为原来的一半,为易错点.

 全能测控一本好卷系列答案
全能测控一本好卷系列答案| A. | 青蒿素的摩尔质量为282g | |
| B. | 青蒿素的化学合成方法没有任何研究意义 | |
| C. | 青蒿素转化为双氢青蒿素是物理变化 | |
| D. | 用乙醚提取黄花蒿叶中的青蒿素比用水效果好 |
| A. |  测定乙醇分子结构 | B. | 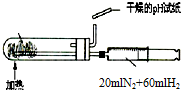 合成氨并检验氨的生成 | ||
| C. |  碘的CCl4溶液中分离I2 | D. |  配制稀硫酸溶液 |
| A. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=+763.3kJ•mol-1 | |
| B. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(l);△H=-763.3kJ•mol-1 | |
| C. | CH3OH(l)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O(g);△H=-675.3kJ•mol-1 | |
| D. | 2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l);△H=-1526.6kJ•mol-1 |
(1)写出一种符合下列要求的物质的化学式:
| 分类标准 | 单质 | 碱性氧化物 | 酸性氧化物 | 含氧酸 | 盐 | 电解质 |
| 属于该类的物质 |
(3)难溶碱性氧化物和强酸反应的化学方程式CuO+2HCl═CuCl2+H2O.
| A. | 铁丝 | B. | 盐酸 | C. | 酒精 | D. | 熔融的NaOH |