题目内容
1.实验室可用氯气与金属铁反应制备无水三氯化铁,该化合物是棕红色,易潮解,100℃左右时升华.如图是两个学生设计的实验装置,左边的反应装置相同,而右边的产品收集装置则不同,分别如(Ⅰ)和(Ⅱ)所示.试回答: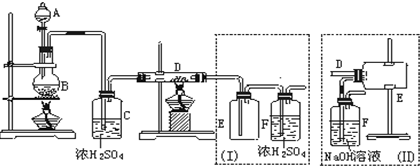
(1)B中反应的化学方程式为:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑.
(2)D中的反应开始前,需排除装置中的空气,应采取的方法是:B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D.
(3)D中反应化学方程式为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3.
(4)装置(Ⅰ)的主要缺点是:导管易被产品堵塞;尾气排入空气,易造成环境污染
(5)装置(Ⅱ)的主要缺点是:产品易潮解.如果选用此装置来完成实验,则必须采取的改进措施是:在瓶E和F之间连接装有干燥剂的装置.
(6)在A,B的装置中,反应一段时间后液体不能顺利流出,应如何改进在A,B的装置间连接一个软橡皮管,平衡内外大气压
(7)在制得的无水三氯化铁含有氯化亚铁,应如何改进在B,C 间加一个饱和的氯化钠水溶液.
分析 (1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)可以用生成的氯气排除装置中的空气;
(3)铁在氯气中燃烧生成氯化铁;
(4)装置(Ⅰ)的主要缺点是导管易被产品堵塞,有毒气体应该有尾气处理装置;
(5)尾气处理装置中有水,导致氯化铁易潮解;
(6)使分液漏斗与烧瓶内压强相等,则分液漏斗中液体能够顺利流下;
(7)浓盐酸易挥发,制取的氯气中含有氯化氢,所以生成产物含有氯化亚铁,依据氯化氢、氯气的溶解性选择合适的除杂剂除去氯化氢.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
故答案为:4HCl+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;
(2)AB处是制取氯气,D是氯气和铁反应,所以先点B处酒精灯,B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D使制取的Cl2排尽装置内的空气,防止铁被空气中氧气氧化;故答案为:B中的反应进行一段时间后,看到黄绿色气体充满装置,再开始加热D;
(3)铁在氯气中燃烧生成氯化铁,化学方程式:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3;
(4)装置(Ⅰ)的主要缺点是导管易被产品堵塞,有毒气体应该有尾气处理装置;
故答案为:导管易被产品堵塞;尾气排入空气,易造成环境污染
(5)该装置中有尾气处理装置,但尾气处理装置中是水溶液,会导致E中有水蒸气,会导致氯化铁产品易潮解,所以为防止氯化铁潮解,在瓶E和F之间连接装有干燥剂的装置;
故答案为:产品易受潮解,可在Ⅱ装置的瓶E和F之间连接装有干燥剂的装置;
(6)用导管将分液漏斗上口与烧瓶口相连或改用恒压滴液漏斗,使分液漏斗与烧瓶内压强相等,分液漏斗中液体则能够顺利流下,
故答案为:在A,B的装置间连接一个软橡皮管,平衡内外大气压;
(7)浓盐酸易挥发,制取的氯气中含有氯化氢,所以生成产物含有氯化亚铁,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,所以可以选择饱和氯化钠除去氯气中的氯化氢,
故答案为:在B,C 间加一个饱和的氯化钠水溶液.
点评 本题以氯化铁的制备为环境,考查了氯气的制备和性质的检验,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等.

| A. | MnO2与浓盐酸反应制Cl2:MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2Cl-+Cl2↑+2H2O | |
| B. | Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| C. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O | |
| D. | 新制的氧化铝可溶于氢氧化钠溶液:Al2O3+2OH-═2AlO2-+H2O |
(1)焦炭可用于制取水煤气.测得12g 碳与水蒸气完全反应生成水煤气时,吸收了131.6
kJ热量.该反应的热化学方程式:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.6kJ•mol-1 .
(2)活性炭可处理大气污染物NO.在2L密闭容器中加入NO和活性炭(无杂质),生成气体E和F.当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:
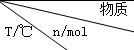 | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应T1℃时的平衡常数为 K1,T2℃时的平衡常数为 K2.
Ⅰ.K1=0.5625.(列式并计算)
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号)c.
a.T1>T2 b.T1<T2 c.无法比较
(3)CO2经常用氢氧化钠溶液来吸收,现有0.4molCO2,若用200mL 3mol/L NaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
(4)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有很高的发电效率,因而受到重视,该电池用 Li2CO3 和 Na2CO3 的熔融盐混合物作电解质,CO 为负极燃气,空气与 CO2 的混合气为正极助燃气,制得在 650℃下工作的燃料电池,其负极反应式:2CO-4e-+2CO32-═4CO2,则正极反应式为:O2+2CO2+4e-=2CO32-.
(5)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10-4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为5.6×10-5mo1/L.
| A. | 1mol NH5中含有5NA个N-H键(NA为阿伏加德罗常数) | |
| B. | NH5中既有共价键,又有离子键 | |
| C. | NH5的电子式为: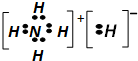 | |
| D. | 与水反应时,水作氧化剂,生成1mol氢气,转移2mol电子 |
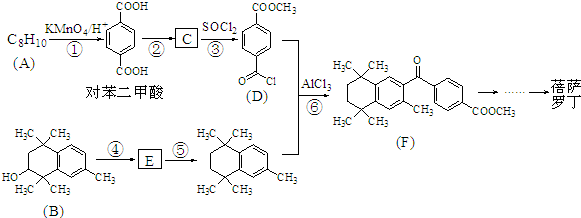
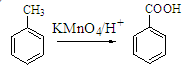 Ⅱ.
Ⅱ.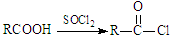
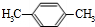 ,C的结构简式为
,C的结构简式为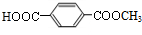 .
. ;⑤
;⑤ .
.