题目内容
10.自由能的变化(△G)是反应方向判断的复合判据:△G=△H-T△S,△G<0时反应正向自发进行.已知某化学反应其△H=-122kJ•mol-1,△S=231J/(mol•K),则此反应在下列哪种情况下可自发进行( )| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
分析 依据反应的焓变和熵变结合温度分析计算,△H-T△S<0说明反应自发进行.
解答 解:反应自发进行需要满足,△H-T△S<0:依据题干条件可知△H-T△S=-122kJ•mol-1-T×231×10-3KJ•mol-1•K-1<0,所以反应一定是在任何温度下都能自发进行,
故选A.
点评 本题考查了反应自发进行的判断依据和计算应用,注意计算过程中焓变和熵变的正负号应用,题目较简单.

练习册系列答案
 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案
相关题目
18.下列表示溶液中发生反应的方程式错误的是( )
| A. | 100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 molCH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- | |
| B. | 4 mol/L的NaAlO2溶液和7 mol/L的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ | |
| C. | 向HCOOK和KOH的混合溶液中加入KMnO42KMnO4+HCOOK+KOH═2K2MnO4+CO2↑+H2O | |
| D. | 在含有Mn2+的溶液中加入HNO3再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
5.某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子.下列描述可能正确的是( )
| A. | 该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 该溶液由等物质的量浓度、等体积的NaOH溶液和CH3COOH溶液混合而成 | |
| C. | 加入适量的NaOH,溶液中离子浓度为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) | |
| D. | 加入适量氨水后,c(CH3COO-)会大于c(Na+)、c(NH4+)之和 |
15.以铂为阳极,铜为阴极,电解硫酸铜溶液,在阳极和阴极上析出物质的质量比是( )
| A. | 1:2 | B. | 8:1 | C. | 1:4 | D. | 4:1 |
2.下列溶液中有关物质的量浓度关系不正确的是( )
| A. | pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 向NH4HSO4溶液中滴加等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| D. | 在浓度均为0.1 mol•L-1Na2CO3、NaHCO3、NH4Cl溶液中c(H+)分别为c1、c2、c3,则c3>c2>c1 |
20.N2和 H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、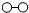 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
 、
、 、
、 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
| A. | 使用催化剂,合成氨反应放出的热量减少 | |
| B. | 在该过程中,N2、H2断键形成N原子和H原子 | |
| C. | 在该过程中,N原子和H原子形成了含有非极性键的NH3 | |
| D. | 合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
 .
.