题目内容
15.以铂为阳极,铜为阴极,电解硫酸铜溶液,在阳极和阴极上析出物质的质量比是( )| A. | 1:2 | B. | 8:1 | C. | 1:4 | D. | 4:1 |
分析 根据电解原理:阳极离子的放电顺序:铜离子>氢离子,阴极离子的放电顺序:氢氧根离子>硫酸根离子,用惰性电极电解硫酸铜溶液,阴极上是铜离子得电子,阳极上是氢氧根离子失电子,电解硫酸铜阶段,当铜离子电解完毕后,阳极上是氢氧根离子失电子,阴极上是氢离子在得电子,电解的最后是电解水,所以可能发生反应2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4、2H2O$\frac{\underline{\;电解\;}}{\;}$O2↑+2H2↑,结合电子守恒分析即可解答.
解答 解:用铂电极电解CuSO4溶液,开始阶段:阴极电极反应:Cu2++2e-=Cu,阳极电极反应:4OH--4e-=2H2O+O2↑,阴阳两极转移电子数相等,假设转移电子是4mol,在阳极和阴极上析出物质的质量比是32:2×64=1:4,C符合,
当铜离子电解完毕后,阳极上是氢氧根离子失电子,阴极上是氢离子在得电子,电解的最后是电解水,阴极电极反应:2H++2e-=H2↑,阳极电极反应:4OH--4e-=2H2O+O2↑,↑阴阳两极转移电子数相等,假设转移电子是4mol,在阳极和阴极上析出物质的质量比是32:2×2=8:1,B符合,
故选BC.
点评 本题是对电解原理的考查,要求熟练应用离子的放电顺序,注意电解硫酸铜溶液的最后是电解水,题目难度中等,电解硫酸铜为两个阶段为易错点.

练习册系列答案
相关题目
6.下列各选项有机物数目,与分子式为ClC4H7O2且能与碳酸氢钠反应生成气体的有机物数目相同的是(不含立体异构)( )
| A. | 分子式为C5H10 的烯烃 | B. | 分子式为C4H8O2 的酯 | ||
| C. | 甲苯(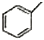 )的一氯代物 )的一氯代物 | D. | 立体烷(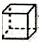 )的二氯代物 )的二氯代物 |
3.某有机物分子中有 n 个-CH 2-,m 个  ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
 ,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )
,a个-CH 3,其余为-OH,则该物质分子中-OH的个数可能为( )| A. | m-a | B. | n+m+a | C. | m+1-a | D. | m-1-a |
10.自由能的变化(△G)是反应方向判断的复合判据:△G=△H-T△S,△G<0时反应正向自发进行.已知某化学反应其△H=-122kJ•mol-1,△S=231J/(mol•K),则此反应在下列哪种情况下可自发进行( )
| A. | 在任何温度下都能自发进行 | B. | 在任何温度下都不能自发进行 | ||
| C. | 仅在高温下自发进行 | D. | 仅在低温下自发进行 |
20.碳及其化合物在自然界中和人类活动中发挥着重要的作用.回答下列问题:
(1)已知常温下,几种弱酸的电离常数如表:
①等物质的量浓度的CH3COONa、NaCN、Na2CO3三种溶液的pH分别为pH1、pH2、pH3,则三者由大到小的顺序为pH3>pH2>pH1
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
(1)已知常温下,几种弱酸的电离常数如表:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
②0.4mol•L-1的CH3COOH溶液与0.2mol•L-1的NaOH溶液等体积混合后,所得溶液中c(H+)>c(OH-)(填“>”“<”或“=”,下同)c(CH3COOH)<c(CH3COO-)
(2)工业生产中用可溶性的碳酸盐浸取石膏固体,写出浸取过程中发生反应的离子方程式:CaSO4+CO32-=CaCO3+SO42-;已知常温时${K}_{sp}(CaC{O}_{3})=2.80×1{0}^{-9}$,${K}_{sp}(CaS{O}_{4})=4.9×1{0}^{-5}$,则此温度下该离子反应的平衡常数K=$\frac{c(S{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$
(3)雾霾袭城的日子越来越多,其中对雾霾“贡献”较大的物质之一是氮氧化物,CH4催化还原可消除氮氧化物的污染. 已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H2
现采集NO2与NO的体积比为1:3的样品,用标准状况下22.4L的CH4处理该样品,恰好完全反应(已知生成物全部为气态)并放出1042.8kJ的热量,则△H2=-1160kJ/mol.
7.下列除去杂质的方法正确的是( )
| A. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| B. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| C. | 除去NaCl溶液中的少量MgCl2:加入适量KOH溶液,过滤 | |
| D. | 除去N2中的少量O2:通过灼热的CuO粉末 |
4.化学与生产生活密切相关,下列说法不正确的是( )
| A. | 食盐可以作为调味剂,也可以调节体液电解质平衡 | |
| B. | 食品保鲜膜、塑料水杯等生活用品的主要成分是聚乙烯 | |
| C. | 化工生产中煤的干馏、石油的分馏、天然气生产甲醇均属于化学变化 | |
| D. | 高铁车厢材料大部分采用铝合金,因为铝合金强度大、质量轻、抗腐蚀能力强 |






 .
. .
. .
. .
.