题目内容
7.下列图示实验正确的是( )| A. |  检验浓硫酸与蔗糖反应产生的二氧化硫 | |
| B. |  分离甲苯和水 | |
| C. |  测量氨气的体积 | |
| D. |  进行二氧化碳喷泉实验 |
分析 A.浓硫酸具有脱水性,使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫具有漂白性、还原性;
B.蒸馏时测定馏分的温度,冷却水下进上出;
C.氨气极易溶于水;
D.二氧化碳在水中的溶解度不大.
解答 解:A.浓硫酸具有脱水性,使蔗糖脱水后,C与浓硫酸反应生成二氧化碳、二氧化硫,二氧化硫具有漂白性、还原性,则图中品红褪色、高锰酸钾褪色可检验浓硫酸与蔗糖反应产生的二氧化硫,故A正确;
B.蒸馏时测定馏分的温度,冷却水下进上出,则温度计的水银球应在烧瓶支管口处,冷水方向下进上出,故B错误;
C.氨气极易溶于水,则不能利用排水法测定氨气的体积,故C错误;
D.二氧化碳在水中的溶解度不大,则图中不能形成喷泉,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、混合物分离提纯、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案
相关题目
20.铝鞣剂在皮革工业有广泛应用.某学习小组以铝灰(主要成分是Al、A12O3、FeO、SiO2等)为原料制备铝鞣剂[Al(OH)2Cl],设计工艺流程如图所示:
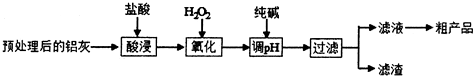
已知:
请回答下列问题:
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是温度太低,反应慢;温度太高,盐酸挥发快.
(2)氧化时的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)调节溶液的pH范围为2.8<pH<3.4.
(4)滤渣中主要含有物质的化学式是SiO2、Fe(OH)3.

已知:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.1 | 2.8 |
| A13+ | 3.4 | 4.7 |
| Fe2+ | 5.8 | 8.8 |
(1)酸浸时温度控制在30℃-35℃,不宜太低,也不宜太高,其原因是温度太低,反应慢;温度太高,盐酸挥发快.
(2)氧化时的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.
(3)调节溶液的pH范围为2.8<pH<3.4.
(4)滤渣中主要含有物质的化学式是SiO2、Fe(OH)3.
18.如表离子能大量共存,且满足相应要求的是( )
| 选项 | 离子 | 要求 |
| A | K+、Cl-、SO42-、MnO4- | c(K+)<c(Cl-) |
| B | Na+、Ca2+、I-、NO3- | c(H+)/c(OH-)=1×1014 |
| C | Al3+、NH4+、SO42-、CH3COO- | 滴加NaOH溶液立刻有气体产生 |
| D | Na+、Mg2+、Ag+、NO3- | 滴加氨水先有沉淀产生,后沉淀部分溶解 |
| A. | A | B. | B | C. | C | D. | D |
12.X、Y、Z、W为四种短周期主族元素,已知原子序数Y>Z>W>X.其中X、Z同主族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6.下列说法正确的是( )
| A. | X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定 | |
| B. | Y元素最高价氧化物对应的水化物化学式为H2YO4 | |
| C. | 原子半径由大到小的顺序为Z>Y>W | |
| D. | X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2 |
19.能正确表示下列反应的离子方程式的是( )
| A. | 用过量石灰乳吸收工业尾气中的SO2:Ca2++2OH-+SO2═CaSO3↑+H2O | |
| B. | 用酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O | |
| C. | 用铜做电极电解NaCl溶液:2C1-+2H2O$\frac{\underline{\;高温\;}}{\;}$H2↑+Cl2↑+2OH- | |
| D. | 将Fe2O3加入到HI溶液中:Fe2O3+6H+═2Fe3++3H2O↑ |
17.下列关于电解质溶液的叙述正确的是( )
| A. | 常温下,相同浓度的盐酸与氨水的混合溶液的pH=7,消耗盐酸的体积大 | |
| B. | 将pH=5的醋酸溶液稀释1000倍,溶液的pH=8 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大 |

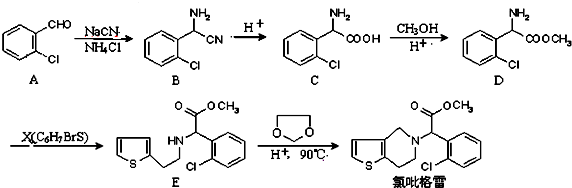
 .
. .
.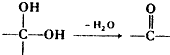
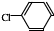 中氯原子较难水解
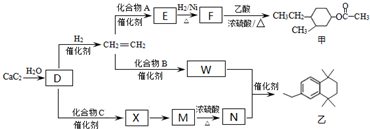
中氯原子较难水解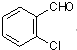 )可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式
)可由2-氯甲苯为原料制得,写出以两步制备A的化学方程式 、
、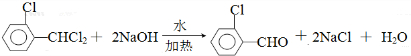 .该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式
.该合成的第一步主要存在产率低的问题,请写出该步可能存在的有机物杂质的结构简式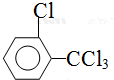 、
、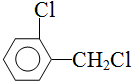 .
.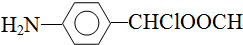 .
.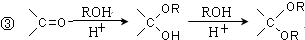
 的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
的合成路线流程图(无机试剂任选).合成路线流程图示例如下:
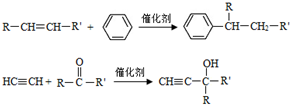 (-R、-R′代表烃基或-H)
(-R、-R′代表烃基或-H)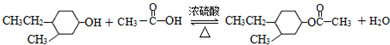 .
.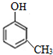 .
.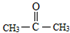 .
.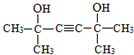 .
.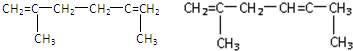 .
.